- Otyłość
- Cukrzyca
- Jak leczyć otyłość
- Trudności w leczeniu dietetycznym otyłości
- Zespół metaboliczny — pojęcie, patofizjologia, diagnostyka i leczenie
- Otyłość – jako stan zagrożenia życia
- Genetyka na widelcu
- GENOdiagDIETA
OTYŁOŚĆ
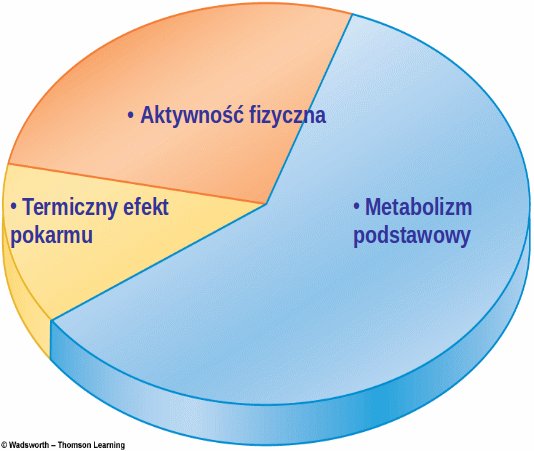
Otyłość to przewlekła choroba, która powstaje w wyniku dodatniego bilansu energetycznego, co jest wynikiem przewagi energii pobranej z pożywienia nad energią wydatkowaną, (czyli energią potrzebną na podstawową przemianę materii, termogenezę i aktywność fizyczną).
WHO definiuje otyłość, jako nadmierne nagromadzenie tkanki tłuszczowej, powodujące rozwój innych chorób.
Ryzyko rozwoju powikłań otyłości różni się w zależności od ilości nadmiaru tkanki tłuszczowej, jej rozmieszczenia oraz czasu trwania choroby (im wcześniej rozwija się w życiu otyłość tym większe ryzyko rozwoju powikłań, stąd tak ważna jest prewencja otyłości już od najmłodszych lat).
Powszechnie przyjętym kryterium rozpoznania otyłości jest wartość wskaźnika masy ciała BMI.
Czynniki odgrywające istotną rolę w powstawaniu otyłości to:
- Czynniki środowiskowe.
- Zmiany nawyków żywieniowych oraz rodzaju spożywanej żywności ( m.in zwiększone spożycie tłuszczów i cukrów, wysoko przetworzonej żywności o dużej gęstości energetycznej, zmniejszone spożycie błonnika pokarmowego), prowadzi to do przekraczania zapotrzebowania energetycznego.
- Zmniejszająca się aktywność fizyczna.
- Przewlekły stres (który niekiedy może być rozładowywany poprzez jedzenie), może się zwiększać w następstwie przyrostu masy ciała- to z kolei prowadzi do obniżenia samooceny oraz izolacji społecznej (powstaje błędne koło ucieczki w jedzenie).
- Czynniki dziedziczne – w większości przypadków rodzinnego występowania otyłości większą rolę niż czynniki genetyczne odgrywa powielanie niekorzystnych nawyków żywieniowych i wzorców spędzania wolnego czasu.
- Zaburzenia emocjonalne:
- Obniżenie samooceny mogące powodować brak samoakceptacji i sprzyjać zachowaniom niekorzystnym dla zdrowia, ale także niewystarczającej motywacji do podejmowania działań.
- Obniżenie nastroju, włącznie z rozwojem depresji.
- Zespół kompulsywnego jedzenia (binge eating disorder-BED) – charakteryzuje się epizodami objadania się, podczas których w krótkim czasie dochodzi do zjedzenia dużej ilości pokarmów, czemu towarzyszy brak poczucia kontroli nad ilością i jakością spożywanych pokarmów oraz występowaniem zachowań świadczących o utracie kontroli (znacznie szybsze jedzenie niż zwykle , jedzenie mimo braku uczucia głodu, jedzenie aż do nieprzyjemnego uczucia w sytości, jedzenie w samotności, uczucie przygnębienia lub winy po przejedzeniu się).
- Uzależnienie od jedzenia.
- Tendencja do nadmiernego i niekontrolowanego jedzenia jest większa u osób u osób silnie przeżywających emocje, takie jak gniew rozdrażnienie i pesymistyczna postawa.
- Otyłość związana z zaburzeniami hormonalnymi, które mogą powodować zmiany w łaknieniu (np. wzrost łaknienia w zespole Cushinga) lub w wydatku energetycznego (np. zmniejszenie podstawowej przemiany materii w niedoczynności tarczycy).
- Wpływ leków, które mogą wpływać na łaknienie lub wydatek energetyczny.
Objawy
Nadmiar tkanki tłuszczowej przez określony czas poza zwiększeniem masy ciała nie daje objawów. Objawy otyłości wynikają głównie z jej powikłań.
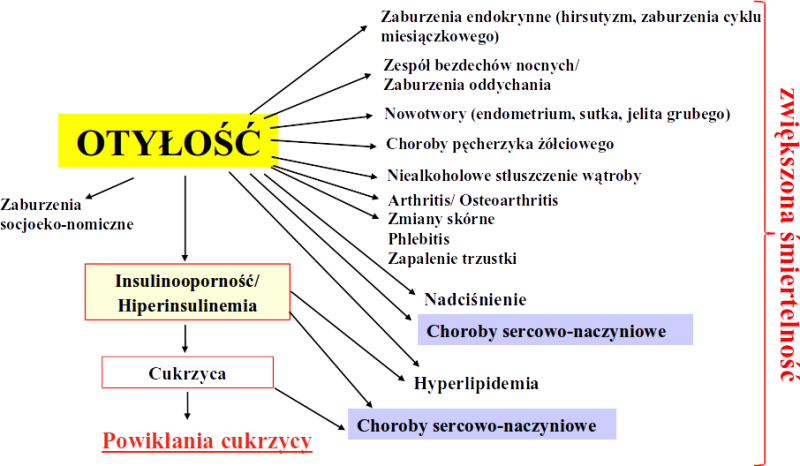
Powikłania niemetaboliczne
- Związane z mechanicznymi konsekwencjami nadmiaru tkanki tłuszczowej:
- choroba zwyrodnieniowa stawów kolanowych, biodrowych i stawów kręgosłupa, związana z przeciążeniami układu ruchu, powodująca bóle stawów, problemy z poruszaniem się,
- żylaki kończyn dolnych i żylna choroba zakrzepowo-zatorowa,
- zespól hipowentylacji spowodowanej otyłością – powoduje duszność problemy z oddychaniem,
- obturacyjny bezdech senny -skutkujący przewlekłą sennością, zmęczeniem w ciągu dnia.
- Inne:
- kamica pęcherzyka żółciowego,
- refluks żołądkowo-przełykowy objawiający się zgagą, czyli piekącym bólem w klatce piersiowej, występującym po posiłkach,
- przepuklina rozworu przełykowego.
- Psychologiczne konsekwencje otyłości:
- niska samoocena,
- zaburzenia wizualizacji własnego ciała,
- izolacja społeczna,
- depresja, obniżony nastrój.
Powikłania metaboliczne
Wynikają z przewlekłego stanu zapalnego i dysfunkcji hormonalnej tkanki tłuszczowej:
- Stany przedcukrzycowe i cukrzyca typu 2.
- Zaburzenia lipidowe.
- Nadciśnienie tętnicze.
- Miażdżyca i jej konsekwencje m.in choroba niedokrwienna serca.
- Niealkoholowe stłuszczenie wątroby.
- Dna moczanowa.
- Nowotwory (przede wszystkim rak jelita grubego, piersi, endometrium, gruczołu krokowego).
- Zaburzenia hormonalne.
Rozpoznanie
Rozpoznanie stawia się po zebraniu rzetelnego wywiadu lekarskiego (dotyczącego również sposobu żywienia oraz aktywności fizycznej) oraz wykonaniu badania fizykalnego.
Ważne jest wykonanie:
- pomiaru masy ciała,
- wyliczenie BMI, co pozwala na określenie stopnia nadwagi i otyłości
Nadwaga 25-29,9
Otyłość I stopnia > 30-34,9
Otyłość II stopnia 35,0-39,9
Otyłosć III stopnia >40 - pomiar obwodu talii, celem ustalenia typu otyłości,
- ocena zawartości poszczególnych składowych masy ciała głównie zawartości tkanki tłuszczowej w organizmie, najczęściej za pomocą metody bioimpedancji.
Zawsze należy czynnie poszukiwać objawów powikłań otyłości i wdrożyć ich intensywne leczenie.
Skuteczne leczenie otyłości wymaga kompleksowego podejścia i współpracy interdyscyplinarnego zespołu. Sukcesem leczenia nie jest liczba utraconych kilogramów, ale trwałość uzyskanych efektów oraz poprawa parametrów metabolicznych i jakości życia.
Bez wdrożenia trwałych modyfikacji stylu życia, w tym prawidłowego żywieni,a leczenie często kończy się niepowodzeniem.
Istotna jest ocena gotowości pacjenta do zaangażowania się pacjenta w leczenie oraz wzmacnianie motywacji chorego do długoterminowego podtrzymania zmian.
CUKRZYCA
Cukrzyca to grupa chorób metabolicznych charakteryzująca się hiperglikemią wynikającą z defektu wydzielania lub działania insuliny.
Przewlekła hiperglikemia w cukrzycy wiąże się z uszkodzeniem, zaburzeniem czynności i niewydolnością różnych narządów, szczególnie oczu, nerek, nerwów i naczyń krwionośnych.
Główne typy cukrzycy:
Cukrzyca typu 1 -spowodowana zniszczeniem komórek beta trzustki przez proces immunologiczny lub nieustalony, co prowadzi do bezwzględnego niedoboru insuliny.
Cukrzyca typu 2- wynika z postępującego upośledzenia wydzielania insuliny, rozwijającego się w warunkach insulinooporności.
CUKRZYCA TYPU 2
Wśród przyczyn rozwoju cukrzycy typu 2 najważniejszą rolę odgrywają:
- Uwarunkowania genetyczne.
- Czynniki środowiskowe.
- Otyłość zwłaszcza brzuszna-ryzyko rozwinięcia cukrzycy rośnie wraz ze zwiększaniem wskaźnika masy ciała (BMI) oraz obwodu talii.
- Mała aktywność fizyczna.
- Inne czynniki ryzyka, wyróżniające grupy zwiększonego ryzyka wystąpienia cukrzycy (patrz poniżej).
Objawy cukrzycy są nieswoiste i zróżnicowane, ponad połowa przypadków cukrzycy typu 2 przebiega bezobjawowo. Niestety również wtedy prowadzi do rozwoju przewlekłych powikłań, w tym sercowo-naczyniowych, (którym sprzyjają również zaburzenia gospodarki węglowodanowej poprzedzające cukrzyce).
Typowymi objawami cukrzycy są:
- wielomocz (poliuria)
- wzmożone pragnienie (polidypsja)
- osłabienie i senność spowodowane odwodnieniem
- chudnięcie (rzadziej)
Objawy te pojawiają się znacznie częściej w cukrzycy typu 1 niż typu 2, podobnie jak kwasica i śpiączka ketonowa, które bywają pierwszą zauważona manifestacja cukrzycy typu 1, zwłaszcza u dzieci i młodzieży.
Rzadkim objawem jest skłonność do ropnych zakażeń skóry lub zakażeń układu moczowo-płciowego.
Stan przed cukrzycowy lub stan zwiększonego ryzyka cukrzycy, rozpoznaje się go na podstawie obecności przynajmniej jednej z poniższych nieprawidłowości:
Nieprawidłowa glikemia na czczo- glikemia na czczo w przedziale 5,6-6,9 mmol/l => jest wskazaniem do wykonania testu OGTT.
Nieprawidłowa tolerancja glukozy-glikemia w 120. min po doustnym obciążeniu 75 g glukozy w przedziale 7,8-11,0 mmol/l.
Cukrzycę rozpoznaje się w 3 sytuacjach
- Przygodna glikemia > 11,1 mmol/l z typowymi objawami cukrzycy.
- 2-krotnie glikemia na czczo > 7.0 mmol/l.
- Glikemia w 120.min po doustnym obciążeniu 75 g glukozy >11,1 mmol/l.
Preferuje się oznaczenie glikemii w osoczu krwi żylnej. Badanie na czczo oznacza pobranie krwi 8-14 g od ostatniego posiłku.
OGTT wykonuje się, jeśli wynik jednokrotnego pomiaru glikemii na czczo wyniesie 5,6-6,9 mmol/l, a także wówczas, gdy przy glikemii < 5,6 mmol/l istnieje uzasadnione podejrzenie nieprawidłowej tolerancji glukozy. Diagnostyki stanów hiperglikemicznych nie należy wykonywa podczas ostrej fazy choroby, bezpośrednio po urazie lub zabiegu operacyjnym, po głodzeniu, ani w trakcie nawet krótkotrwałego stosowania leków mogących zwiększa glikemię.
Należy koniecznie dążyć do wczesnego rozpoznania i czynnie poszukiwać cukrzycy oraz stanów przedcukrzycowych, poprzez wykonywanie przesiewowych badań diagnostycznych (glikemia na czczo, OGTT). Badania należy wykonywa raz w roku, jeśli występują czynniki zwiększonego ryzyka zachorowania na cukrzycę:
- Rozpoznany wcześniej stan przedcukrzycowy.
- Nadwaga i otyłość.
- Cukrzyca występująca u rodziców i rodzeństwa.
- Mała aktywność fizyczna lub nagłe zaprzestanie aktywności fizycznej.
- Przebyta cukrzyca ciążowa.
- Urodzenie dziecka o masie ciała>4 kg.
- Nadciśnienie tętnicze.
- Dyslipidemie.
- Zespół policystycznych jajników.
- Choroba układu sercowo-naczyniowego.
- Mukowiscydoza.
Powyżej 45 roku życia każdy powinien się badać co 3 lata!
Leczenie
Leczenie jest kompleksowe i wymaga zastosowania kilku, a czasem wszystkich niżej wymienionych metod równocześnie:
- Edukacja terapeutyczna!
- Leczenie dietetyczne.
- Wysiłek fizyczny.
- Leczenie farmakologiczne doustnymi lekami hipoglikemizującymi, lekami działającymi na układ inkretynowy insuliną.
- Zwalczanie czynników ryzyka choroby sercowo-naczyniowej, zwłaszcza nadciśnienia tętniczego i dyslipidemii.
- Leczenie powikłań cukrzycy.
JAK LECZYĆ OTYŁOŚĆ – PRZEGLĄD AKTUALNYCH METOD TERAPII
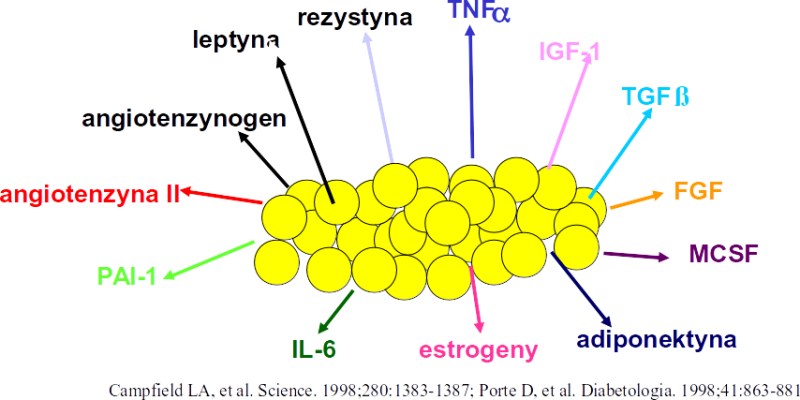
Stale wzrastająca częstość występowania otyłości powoduje, że jest ona istotnym problemem stanowiącym o zagrożeniu zdrowia publicznego. Otyłość jest złożoną, wieloczynnikową chorobą, spowodowaną stylem życia promującym dodatni bilans energetyczny, występującą u osób z genetyczną predyspozycją do niej [1, 2]. Obecnie obserwuje się narastanie częstości otyłości. W badaniach epidemiologicznych przeprowadzonych w Stanach Zjednoczonych od 1980 roku stwierdzono 2-krotnie większą częstość występowania otyłości oraz 3-krotnie większy wzrost nadwagi. W ostatniej dekadzie XX wieku zaobserwowano także zwiększenie częstości otyłości u dzieci [3]. Podobnie w Polsce nadwagę stwierdzono u 53% osób dorosłych [4]. Częste występowanie otyłości w populacji stanowi groźbę wybuchu epidemii cukrzycy typu 2 oraz innych powikłań otyłości [1]. Zaburzenia metaboliczne występujące u osób otyłych, jak insulinooporność i hiperinsulinizm, zaburzenia lipidowe, hormonalne, pobudzenie aktywności układu adrenergicznego, stan prozakrzepowy, stanowią składowe zespołu metabolicznego. Klinicznymi konsekwencjami otyłości i zespołu metabolicznego są choroba układu sercowo-naczyniowego, udar mózgu, cukrzyca typu 2, stłuszczenie wątroby i upośledzenie jej funkcji, kamienie cholesterolowe w pęcherzyku żółciowym, niektóre typy nowotworów [5–7].
Podstawowym celem procesu leczenia otyłości jest zmniejszenie ryzyka chorób jej towarzyszących, poprawa zaburzeń metabolicznych oraz profilaktyka wzrostu masy ciała. Istotna w tym procesie jest likwidacja nieprawidłowych zaburzeń żywieniowych i zmiana stylu życia pacjenta. Obecnie dostępne metody leczenia otyłości obejmują: modyfikację stylu życia wraz z ograniczeniami dietetycznymi i zwiększeniem aktywności fizycznej, terapię psychologiczną (behawioralną), leczenie farmakologiczne oraz operacyjne.
Wybór metody terapii zależy od stopnia otyłości oraz oceny ryzyka chorób towarzyszących. Przy nadwadze bez obecności zaburzeń metabolicznych należy wdrożyć modyfikację stylu życia i dodatkowo wsparcie psychologiczne. W przypadku otyłości I stopnia [wskaźnik masy ciała (BMI, body mass index): 30–35 kg/m2]do tego programu trzeba dołączyć leczenie farmakologiczne. Jeżeli istnieją czynniki ryzyka miażdżycy, farmakoterapię należy rozpocząć już przy BMI powyżej 27 kg/m2. Do leczenia otyłości olbrzymiej (BMI > 40 kg/m2), po niepowodzeniu terapii zachowawczej, stosuje się leczenie chirurgiczne. Natomiast gdy istnieją powikłania otyłości olbrzymiej, chorego można od razu zakwalifikować do leczenia operacyjnego [1].
Podstawą leczenia redukującego masę ciała jest racjonalna, indywidualnie dobrana dla chorego dieta. Pacjent powinien być przeszkolony w zakresie prawidłowego żywienia przez doświadczonego dietetyka. Prawidłowo skomponowana dieta powinna stanowić zrównoważone jakościowo pożywienie dostarczające składniki odżywcze zgodnie z normami żywieniowymi, nie prowadzić do niedoborów pokarmowych i być zgodna z kulturowymi zwyczajami żywieniowymi. Podstawowe zalecenia obejmują ograniczenie spożycia cukrów prostych i pokarmów bogatotłuszczowych oraz wysoko przetworzonych. Deficyt energetyczny nie powinien przekraczać 25–35% średniego spożycia dziennego. Na podstawie badań epidemiologicznych stwierdzono skuteczność leczenia dietetycznego otyłości i współistniejących zaburzeń metabolicznych w postaci poprawZey profilu lipidowego, obniżenia stężenia inhibitora aktywatora plazminogenu 1 (PAI-1, plasminogen activator inhibitor-1), a także jego rolę w prewencji cukrzycy typu 2 [8–11].
Kolejnym elementem terapeutycznym w leczeniu otyłości jest wysiłek fizyczny. Skuteczne jest stopniowe zwiększanie podstawowej aktywności fizycznej aż do wprowadzania intensywniejszych ćwiczeń. Zalecane obciążenie powinno wynosić 50–70% VO2max, tak aby zwiększenie wydatku energetycznego wynosiło 100–200 kcal/dobę (maksymalnie 300 kcal/dobę). Zaleca się stopniowe zwiększanie częstotliwości sesji ćwiczeniowych od początkowo 3 razy w tygodniu do codziennych ćwiczeń po 30– –45 minut [1]. Istotny jest także indywidualny dobór ćwiczeń dla chorego ze względu na ograniczenia ortopedyczne. W przypadku otyłości olbrzymiej nie zaleca się wysiłku obciążającego układ szkieletowomięśniowy, takie jak: bieganie, gra w piłkę, schodzenie po schodach, jazda na nartach czy wspinaczka wysokogórska [1]. Zastosowanie zwiększonej aktywności fizycznej powoduje znaczącą poprawę w zakresie redukcji masy ciała, zmniejszenie ilości tkanki tłuszczowej brzusznej oraz zwiększenie wydolności układu oddechowego i układu krążenia [11–14]. Należy sobie jednak zdawać sprawę z trudności związanych ze zmianą stylu życia i dawnych nawyków chorego, z tego powodu powinno mu się zapewnić stałe wsparcie zarówno ze strony personelu medycznego, jak i rodziny.
W zakresie stosowania i utrwalania korzystnych nawyków żywieniowych istotna jest pomoc psychologiczna. Zajęcia psychologiczne dla otyłych pacjentów spełniają dwie zasadnicze funkcje — zwiększają świadomość chorego o zaburzeniach łaknienia i pomagają w zwiększeniu kontroli nad jedzeniem oraz stanowią wsparcie wynikające z przynależności do grupy i działań psychoterapeuty. Działania terapeutyczne mają ponadto na celu zmianę nieprawidłowych zachowań żywieniowych i utrwalenie zdrowych nawyków [1].
Leczenie farmakologiczne powinno się rozważyć w przypadku braku efektywności powyższych elementów leczniczych po okresie 3–6 miesięcy. Dotychczas stosowano wiele leków, z których jednak większość okazała się nieskuteczna w terapii długotrwałej lub niebezpieczna. Efektywnym lekiem wpływającym na redukcję masy ciała jest sibutramina. Jest to lek o podwójnym działaniu adrenergicznoserotoninergicznym. Poprzez hamowanie wychwytu zwrotnego monoamin pobudza ośrodek sytości i hamuje podwzgórzowy ośrodek głodu, a poprzez stymulację współczulną receptorów b3 w tkance tłuszczowej brunatnej powoduje nasilenie termogenezy. Wykazuje długoterminowy wpływ na masę ciała, zmniejszenie ilości tłuszczu brzusznego, poprawę glikemii i profilu lipidowego [14–16]. Jest także skuteczna u chorych na cukrzycę [17]. Działania niepożądane leku to: bóle głowy, suchość w ustach, anoreksja, bezsenność i zaparcia. Dobowa dawka 10–15 mg może spowodować przyspieszenie akcji serca i wzrost ciśnienia tętniczego, który skutecznie można opanować, dołączając do leczenia małą dawkę leku b-adrenolitycznego. Podczas leczenia należy kontrolować wymienione parametry. Przeciwwskazaniami do stosowania sibutraminy są choroba wieńcowa i schorzenia tętnic przebiegające ze zwężeniem światła, źle kontrolowane nadciśnienie tętnicze, ciężkie uszkodzenie nerek i wątroby.
Kolejnym stosowanym w leczeniu otyłości lekiem jest orlistat — hamujący selektywnie działanie lipazy trzustkowej i zmniejszający wchłanianie tłuszczów z przewodu pokarmowego. Orlistat działa w ścianie przewodu pokarmowego i jest całkowicie wydalany przez ten przewód. Powoduje zahamowanie wchłaniania tłuszczów i wydalenie 30% spożytych tłuszczów wraz ze stolcem. U otyłych chorych na cukrzycę lek ten ma także niezależny pozytywny wpływ na profil lipidowy, poprawę kontroli glikemii oraz istotnie zmniejsza wartości ciśnienia tętniczego [18, 19]. Ponadto wykazano skuteczność orlistatu w prewencji cukrzycy typu 2 oraz w redukcji innych czynników ryzyka chorób układu sercowonaczyniowego, takich jak nadciśnienie tętnicze i zaburzenia lipidowe [20–22]. Wykazano także wpływ tego leku na zwiększenie poposiłkowego stężenia glukagonopodobnego peptydu-1 (GLP-1, glucagon like peptide-1) [23]. Objawy niepożądane dotyczą głównie przewodu pokarmowego. Lek stosuje się w dawce 120 mg 3 razy dziennie w czasie głównych posiłków, łącznie z łagodną dietą niskokaloryczną, bogatą w owoce i warzywa. Przeciwwskazaniami do podawania orlistatu są zespół upośledzonego wchłaniania, cholestaza i ciąża.
Kolejnym nowym lekiem jest antagonista receptorów kannabinoidowych CB1 — rimonabant. Receptory te znajdują się w ośrodkowym układzie nerwowym w podwzgórzu i układzie limbicznym oraz w tkance tłuszczowej, w przewodzie pokarmowym, mięśniach i wątrobie. Ich aktywacja powoduje mniejsze uwalnianie neurotransmiterów w mózgu [24]. Układ kannabinoidowy obejmujący endogenne endokannabinoidy wraz ze specyficznymi receptorami CB1 i CB2 wpływa na kontrolę poboru pokarmu i modulowanie jedzenia związanego z odczuwaniem przyjemności, a także na bilans energetyczny [25]. W programach badawczych RIO (Rimonabant in Obesity) wykazano pozytywny wpływ rimonabantu na redukcję masy ciała [26, 27]. Stwierdzono także poprawę w zakresie profilu lipidowego, a zwłaszcza zwiększenie stężenia cholesterolu frakcji HDL i obniżenie stężenia triglicerydów oraz zmianę proporcji małych, gęstych cząsteczek LDL cholesterolu na korzyść dużych cząsteczek LDL [26]. U chorych na cukrzycę wykazano poprawę wyrównania cukrzycy w postaci obniżenia stężenia hemoglobiny glikowanej (HbA1c)[28]. Główne objawy niepożądane to: depresja, nudności, zawroty głowy. Nie stwierdzono niekorzystnego wpływu na układ sercowo- naczyniowy. Jednak lek ten nie został zarejestrowany przez Food and Drug Administration (FDA) z powodu znacznego odsetka objawów niepożądanych w postaci depresji z myślami samobójczymi — aż do 30% w terapii długofalowej.
Dodatkowo w celu prewencji rozwoju cukrzycy oraz poprawy w zakresie zaburzeń lipidowych do leczenia otyłości wprowadza się także leki zmniejszające insulinooporność, takie jak biguanidy i tiazolidinediony. W badaniu Diabetes Prevention Program stwierdzono 31-procentową redukcję ryzyka wystąpienia cukrzycy przy zastosowaniu metforminy u otyłych pacjentów [29]. Z tego powodu u otyłych chorych na cukrzycę dużą skuteczność wykazuje łączne stosowanie metforminy z sibutraminą.
Współczesne techniki chirurgiczne obejmują redukcję objętości żołądka poprzez wykonanie gastroplastyki żołądka, wraz z jego bypassem, dystalnej gastrektomii oraz usunięcie większej części żołądka z połączeniem opuszki dwunastnicy z żołądkiem, opaskowanie żołądka, stymulację żołądka wszczepionym stymulatorem, zakładanie wewnątrzżołądkowych balonów i wreszcie neuromodulację aktywności nerwów błędnych za pomocą mikrochipów. Wszystkie te zabiegi można przeprowadzić techniką laparoskopową. Stwarza to możliwość szybszego gojenia ran i mniejszy odsetek przepuklin w bliźnie pooperacyjnej, mniejsze upośledzenie wydolności oddechowej oraz krótszy czas hospitalizacji. Obecnie chirurgiczną metodą referencyjną jest zmniejszenie objętości żołądka za pomocą gastroplastyki z bypassem żołądka metodą Roux-en-Y, dzięki której uzyskuje się 30–40-procentową redukcję masy ciała. Częstym zabiegiem jest także laparoskopowy zacisk żołądkowy (Lap-Band System). Wyniki badań wskazują na znaczną poprawę w zakresie zaburzeń metabolicznych wraz z szybką redukcją masy ciała, jaka następuje po takim leczeniu operacyjnym [30– –32]. Ta poprawa wiąże się nie tylko z mechanicznym zmniejszeniem żołądka, ale także z modyfikacją wydzielania peptydów jelitowych — spadkiem stężenia greliny i zwiększeniem wydzielania peptydu YY oraz GLP-1 [33]. Najczęściej spotykanymi powikłaniami tego rodzaju zabiegów są powikłania okołooperacyjne oraz niedobory pokarmowe. Wydaje się, że obecnie techniki operacyjne są najskuteczniejszą (o długotrwałym efekcie) metodą leczenia otyłości, zwłaszcza olbrzymiej. Z długofalowych badań epidemiologicznych wynika, że ten sposób leczenia prowadzi do utrzymywania się redukcji masy ciała po 10 latach średnio o 14–25%, zwiększa przeżywalność chorych, zmniejszając ich umieralność z wszystkich przyczyn, a zwłaszcza z przyczyn sercowo- naczyniowych, z powodu nowotworów, poprawia jakość ich życia, co często umożliwia powrót do pełnej aktywności zawodowej i społecznej [34, 35]. Podsumowując, skuteczne leczenie otyłości wymaga współdziałania zespołu leczącego obejmującego: lekarza, dietetyka, psychologa, edukatora, fizjoterapeutę i chirurga. W konsekwencji nawet 5-procentowa redukcja masy ciała przynosi istotne korzyści związane ze zmniejszeniem ryzyka sercowo- naczyniowego i śmiertelności.
PIŚMIENNICTWO
- Raport of the WHO consultation. Obesity: preventing and managing the global epidemic. World Health Organ. Tech. Rep. Ser. 2000; 894: 1–253.
- National Institutes of Health, National Heart, Lung and Blood Insitute. Obesity Education Initiative: Clinical Guidelines on the identification, evaluation, and treatment of overweight and obesity in adults. The Evidence Report: US Department of Health and Human Services, Public Health Service, NIH, HHLBI. Bethesda 1998.
- Pi-Sunyer X. The role of weight loss in improving metabolic outcoms. Clinical update. Medscape 2002; 3: 1–15.
- Zdrojewski T., Babinska Z., Bandosz P. i wsp. Związek nadwagi i otyłości z podwyższonymi wartościami ciśnienia tętniczego w badaniach reprezentatywnych grup dorosłych Polaków w 1997 i 2002 r. (NATPOL II, NATPOL III). Medycyna Metaboliczna 2002; 4 (supl.): 32.
- Kahn B., Flier J. Obesity and insulin resistance. J. Clin. Invest. 2000; 106: 473–481.
- Field A., Coakley E., Spadano J. Impact of overweight on the risk of developing common chronic disease during 10-year period. Arch. Intern. Med. 2001; 161: 1581–1586.
- Calle E., Rodriguez C., Walker-Thrumend K., Thun M. Overweight, obesity and mortality from cancer in prospectively studied cohort of U.S. adults. N. Engl. J. Med. 2003; 348: 1625–1638.
- McAuley K., Wiliams S., Mann J. i wsp. Intensive lifestyle changes are necessary to improve insulin sensitivity: a randomised controlled trial. Diabetes Care 2002; 25: 445–452.
- Uusitupa M., Lindi V., Louheranta A., Salopuro T., Lindström J., Tuomilehto J.; for the Finnish Diabetes Prevention Study Group. Long-term improvement in insulin sensitivity by changing lifestyles of people with impaired glucose tolerance 4-year results from the Finish Diabetes Prevention Study. Diabetes 2003; 52: 2532–2538.
- Lindström J., Louheranta A., Mannelin M. i wsp.; for the Finnish Diabetes Prevention Study Group. The Finnish Diabetes Prevention Study (DPS). Lifestyle intervention and 3-year results on diet and physical activity. Diabetes Care 2003; 26: 3230–3236.
- Van der Bruggen M., Bos G., Bemelmans W., Hoogenveen R., Vijgen S., Baan C. lifestyle interventions are cost-effective in people with different levels of diabetes risk. results from a modelling study. Diabetes Care 2007; 30: 128–134.
- Tuomiletho J., Lindström J., Eriksson J. i wsp. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N. Engl. J. Med. 2001; 344: 134–1350.
- Wing R., Goldstein M., Acton K. i wsp. Behavioural science research in diabetes. Lifestyle changes related to obesity, eating behavioural and physical activity. Diabetes Care 2001, 24: 117–123.
- Gokcel A., Karakose H., Erotrer E, Tanaci N., Tutuncu N., Guvener N. Effects of sibutramine in obese female subjects with type 2 diabetes and poor blood glucose control. Diabetes Care 2001; 24: 1957–1960.
- Finer N., Bloom S., Frost G., Banks L., Griffiths J. Sibutramine for weight loss and diabetic control in obesity with type 2 diabetes: a randomised, double-blind, placebo-controlled study. Diabetes Obes. Metab. 2000; 2: 105–112.
- James W., Astrup A., Finer N. i wsp. Effect of sibutramine on weight maintains after weight loss: a randomised trial. STORM Study Group. Sibutramine Trial of Obesity Reduction and Maintenance. Lancet 2000; 356: 2119–2125.
- Redmon B., Reck K., Raatz S. i wsp. Two-year outcome of a combination of weight loss therapies for type 2 diabetes. Diabetes Care 2005; 28: 1311–1315. 18. Miles J., Leiter L., Hollander P. i wsp. Effect of orlistat in overweight and obese patients with type 2 diabetes treated with metformin. Diabetes Care 2002; 25: 1123–1128. 19. Kelley D., Kuller L., Mkolanis T., Harper P., Mancino J., Kalhan S. Effects of moderate weight loss and orlistat on insulin resistance, regional adiposity, and fatty acids in type 2 diabetes. Diabetes Care 2004; 27: 33–44.
- Miles J., Leiter L., Hollander P. i wsp. Effect of orlistat in overweight and obese patients with type 2 diabetes treated with metformin. Diabetes Care 2002; 25: 1123–1128.
- Kelley D., Kuller L., Mkolanis T., Harper P., Mancino J., Kalhan S. Effects of moderate weight loss and orlistat on insulin resistance, regional adiposity, and fatty acids in type 2 diabetes. Diabetes Care 2004; 27: 33–44.
- Torgerson J., Hauptman J., Boldrin M., Oström L. XENical in the Prevention of Diabetes in Obese Subjects (XENDOS) Study. A randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27: 155–161.
- Lamotte M., Annemans L., Lefever A., Nechelput M., Masure J. A health economic model to assess the long-term effects and cost-effectiveness of orlistat in obese type 2 diabetic patient. Diabetes Care 2001; 25: 303–308.
- Richelsen B., Tonstad S., Rössner S. i wsp. Effect of orlistat on weight regain and cardiovascular risk factors following a verylow- energy diet in abdominally obese patients. Diabetes Care 2007; 30: 27–32.
- Damci T., Yalin S., Balci H. i wsp. Orlistat augments postprandial increases in glucagon-like peptide 1 in obese type 2 diabetic patients. Diabetes Care 2004; 27: 1077–1080. 24. Cota D., Marcisano G., Vicannati V., Stalla G., Pasqualli R., Pagotto U. Endogenous cannabinoid system as modulator of food intake. Int. J. Obes. 2003; 27: 189–301.
- Cota D., Marcisano G., Vicannati V., Stalla G., Pasqualli R., Pagotto U. Endogenous cannabinoid system as modulator of food intake. Int. J. Obes. 2003; 27: 189–301.
- Cota D., Marcisano G., Tschop M. The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis. Int. J. Obes. 2003; 112: 423–431.
- Van Gaal L., Rissanen A., Scheen A., Ziegler O., Rossner S. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. Lancet 2005; 365: 1389–1397.
- Pi-Sunyer F., Aronne L., Heshmati H., Devin J., Rosenstock J. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: a randomized controlled trial. JAMA 2006; 295: 761–775.
- Scheen A., Finer N., Hollander P., Jensen M., Van Gaal L., RIO-Diabetes Study Group. Efficacy and tolerability of rimonabant in overweight or obese patients with type 2 diabetes: a randomised controlled study. Lancet 2006; 368: 1632–1634.
- Diabetes Prevention Program Research Group. Reduction in the incidents of type 2 diabetes with lifestyle intervention or metformin. N. Engl. J. Med. 2002; 346: 393–403.
- Pender C., Goldfine I., Tanner C., Pories W. Muscle insulin receptor concentrations in obese patients post bariatric surgery: relationship to hyperinsulinemia. Intern. J. Obesity 2004; 28: 363–369.
- Dixon J., O’brien J. Health outcomes of severely obese type 2 diabetic subjects 1 year after laparoscopic adjustable gastric banding. Diabetes Care 2002; 25: 358–363.
- Morabito A., Doldi S. Laparoscopic gastric banding prevents type 2 diabetes and arterial hypertension and induces their remission in morbid obesity. A 4-year case-controlled study. Diabetes Care 2005; 28: 2703–2709.
- le Roux C., Aylwin S., Batterham R. Gut hormone profiles following bariatric surgery favor an anorectic state, facilitate weight loss, and improve metabolic parameters. Ann. Surg. 2006; 243: 108–114.
- Adams T., Gress R., Smith S. Long-term mortality after gastric bypass surgery. N. Engl. J. Med. 2007; 357: 753–761. 35. Sjöström L., Narbro K., Sjöström D. i wsp. for the Swedish Obese Subjects Study. Effects of bariatric surgery on mortality in swedish obese subjects. N. Engl. J. Med. 2007; 357: 741–752.
- Sjöström L., Narbro K., Sjöström D. i wsp. for the Swedish Obese Subjects Study. Effects of bariatric surgery on mortality in swedish obese subjects. N. Engl. J. Med. 2007; 357: 741–752.
TRUDNOŚCI W LECZENIU DIETETYCZNYM OTYŁOŚCI
Otyłość jest stale narastającym problemem współczesnego społeczeństwa. Przyczyny epidemii otyłości są wieloczynnikowe, ale najbardziej odpowiada za nią przewlekły dodatni bilans energetyczny spowodowany przez takie czynniki jak dysfunkcja układu neurochemicznego regulującego przyjmowanie pokarmu i przemiany energetyczne organizmu, oraz predyspozycja genetyczna i czynniki środowiskowe [1,2]. W badaniach epidemiologicznych w Stanach Zjednoczonych stwierdzono dwukrotny wzrost występowania otyłości oraz trzykrotny wzrost nadwagi w ciągu ostatnich 25 lat. Obserwuje się także wzrost częstości otyłości u dzieci [3]. Obecnie nawyki żywieniowe uległy zmianie. Przez ostatnie 20lat wielkość standardowej porcji w restauracjach szybkiej obsługi wzrosła dwukrotnie, kolejną zmianą jest zwiększenie ilości przyjmowanych kalorii wynikające z wysokiego użycia syropów zawierających fruktozę i syntetycznych środków słodzących w wielu produktach spożywczych, a w szczególności w napojach oraz zmniejszenie przyjmowania produktów mlecznych [4].
Celem leczenia otyłości jest poprawa zaburzeń metabolicznych oraz profilaktyka ponownego wzrostu masy ciała. Leczenia to obejmuje modyfikację stylu życia wraz z ograniczeniami dietetycznymi i zwiększeniem aktywności fizycznej, terapię psychologiczną, leczenie farmakologiczne oraz operacyjne. Wybór metody zależy od stopnia otyłości oraz współistnienia chorób towarzyszących. Jednak podstawowym elementem leczenia jest racjonalna, indywidualnie dobrana dla chorego dieta. Bardzo ważną rolę odgrywa szkolenie dietetyczne w zakresie prawidłowego żywienia przez do- świadczonego dietetyka. Prawidłowo skomponowana dieta powinna stanowić zrównoważone jakościowo pożywienie dostarczające składniki odżywcze zgodnie z normami żywieniowymi. Dieta redukcyjna nie może prowadzić do niedoborów pokarmowych i zapewnić choremu w różnorodność składników mineralnych i witamin. Bardzo ważne jest także zgodność zalecanej diety z kulturowymi zwyczajami żywieniowymi chorego. Podstawowymi zaleceniami są ograniczenie spożycia cukrów prostych i pokarmów bogato-tłuszczowych oraz wysoko-przetworzonych. Należy także zwrócić uwagę, aby deficyt energetyczny nie przekracza ł 25-35% przeciętnego spożycia dziennego kalorii. Wdrożenie takich zaleceń jest trudne i czasochłonne, wymaga szczegółowej analiza zachowań żywieniowych chorego. Jednak właściwy dobór diety zarówno pod względem deficytu energetycznego jak i składu umożliwia przestrzeganie zaleceń przez chorego. W celu osiągnięci skutecznego efektu leczniczego istotne jest także stopniowe zmniejszanie kaloryczności diety z naciskiem na modyfikacje zachowań. W składzie diety według Polskiego Towarzystwa Diabetologicznego węglowodany powinny stanowić 45-50% wartości energetycznej diety, w tym szczególnie węglowodany o niskim indeksie glikemicznym. Tłuszcze natomiast powinny zapewniać 30-35% wartości energetycznej diety, należy także zwrócić uwagę na rodzaj tłuszczu, gdyż tłuszcze nasycone powinny stanowić 10%, także 10% tłuszcze jednonienasycone oraz tłuszcze wielonienasycone od 6 do 10% wartości energetycznej diety. Natomiast udział energetyczny białka w diecie powinien wynosić 15- 20% ze zwiększeniem zawartości białka pochodzenia roślinnego w diecie, tak aby stosunek białka zwierzęcego do roślinnego wynosił co najmniej 50% do 50%. [5]. W praktyce te podstawowe zalecenia obejmują spożywanie dużej ilości warzyw i owoców. Prawidłowa dieta powinna opierać się na produktach spożywczych zawierających węglowodany pochodzące z pełnego ziarna, owoców, warzyw oraz mleka z niską zawartością tłuszczu. Powinno się zwiększyć w diecie zawartość warzyw od 3 do 5 porcji dzienne. Zwierają one naturalnie mało tłuszczy, a wiele witamin, minerałów i błonnik, stanowiąc dobrą przekąskę pomiędzy posiłkami, szczególnie istotne są nieskrobiowe warzywa takie jak szpinak, marchew, brokuły, zielony groszek, cykoria, kapusta, brukselka, kalafior, marchewka, pietruszka, ziemniaki, sałata. Także zalecane jest spożywanie większej ilości ziaren i przetworów z ziaren, jak brązowego ryżu czy makarony z pełnego ziarna. Spożywanie większej ilości białka pochodzenia roślinnego (groch, fasola, kukurydza) oraz zwiększenia białka pochodzącego z ryb. Z produktów pochodzenia zwierzęcego zaleca się ograniczenie ilości tłuszczy nasyconych poprzez wybór „chudego” mięsa jak polędwica wołowa lub wieprzowa, usuwanie skóry z kurczaka lub indyka, stosowanie produkt ów niskotłuszczowych jak mleko odtłuszczone, jogurt niskotłuszczowy, chude sery. Używania większej ilości oliwy zamiast stałych tłuszczy. Ponadto zaleca się picie wody mineralnej oraz niskokalorycznych napojów. Zalecenia dietetyczne obejmują także modyfikacje nawyk ów żywieniowych chorego, poprzez zwrócenie uwagi na sposób przygotowywania pokarmów i wybór metody. Polecane niskotłuszczowe obróbki przetwór ów spożywczych to gotowanie, pieczenie, użycie mikrowali, grilowanie, gotowanie na parze. Powolne jedzenie powoduje szybkie uczucie pełności, a w konsekwencji spożycie mniejszej porcji. Dobrym sposobem na zmniejszenie porcji jest także używanie mniejszych talerzy. Kolejne proste sposoby to uniknie półek z ulubionym jedzeniem oraz dok ładne sprawdzanie etykiet z zawartością kaloryczną danego produktów. Stosowanie małych przekąsek między posiłkami w postaci warzyw, płatków owsianych czy musli. W celu ograniczenia spożycia soli, stosowanie większej ilości przypraw (oregano, bazylia, tymianek, rozmaryn). Badania epidemiologiczne wykazują skuteczność takiego postępowania w zakresie redukcji masy ciała i poprawy zaburzeń metabolicznych [6-12]. Badania Finnish Prevention Study [7-9] oraz Diabetes Prevention Program [10]wykazały, ze intensywna modyfikacja stylu życia osób z zaburzoną gospodarką węglowodanów ą w postaci stanu przedcukrzycowego zmniejsza całkowite ryzyko rozwoju cukrzycy o 58%.
Jakkolwiek terapeutyczna modyfikacja stylu życia ma swoje ograniczenia. W badaniach Wadden i wsp. stwierdzono, że większość chorych nie przestrzega długofalowo zaleceń i często po uzyskaniu wstępnej redukcji masy ciała wraca do poprzednich nawyków. Więcej niż połowa otyłych chorych wymaga jednak dodatkowego postępowania farmakologicznego lub interwencji chirurgicznej [13]. Pułapki odchudzania to zastosowanie się do krótkoterminowych diet, niż zmiana nawyków żywieniowych [14]. Większość chorych uważa także, że przestrzeganie diety przez krótki czas i osiągnięcie redukcji masy ciała pozwala na powrót do ponownych przyzwyczajeń. Także powszechna wiara pacjentów w skuteczność różnorodnych „magicznych” diety pozwala w określonym czasie osiągnąć zamierzony cel terapeutyczny. Jednakże takich diet nie ma, jak wykazano w rocznej obserwacji oceniającej skuteczność różnych zaleceń dietetycznych, każda metoda prowadziła do umiarkowanej redukcji masy ciała oraz redukcji czynników sercowo-naczyniowego [15]. Po zakończeniu kuracji większość chorych ma tendencje do ponownego przyboru masy ciała, z powodu powrotu do „starych” nawyków żywieniowych i brak przyzwyczajenia do nowych zaleceń. Wreszcie fizjologiczna adaptacja organizmu do ograniczeń spożycia energii [16].
Podsumowując skuteczne leczenie otyłości wymaga współdziałania zespołu leczącego obejmującego lekarza, dietetyczkę, psychologa, edukatora, fizjoterapeutę i chirurga. Oczywiście najważniejsze jest konsekwentne przestrzeganie zaleceń dietetycznych przez pacjenta. W celu poprawy motywacji chorego, warto przekazać, że nawet 5% redukcja masy ciała przynosi istotne korzyści związane z redukcją ryzyka sercowo-naczyniowego i śmiertelności [17,18].
Piśmiennictwo
1. Raport of the WHO consultation: Obesity: preventing and managing the global epidemic. World Health Organ Tech Rep Ser 2000, 894: 1-253.
2. Mokdad AH, Bowman BA, Ford ES, Vinicor F, Marks JS, Koplan JP. The continuing epidemics of obesity and diabetes in the United States. JAMA. 2001; 286: 1195-2000.
3. National Institutes of Health, National Heart, Lung and Blood Insitute. Obesity Education Initiative: Clinical Guidelines on the identification, evaluation, and treatment of overweight and obesity in adults. The Evidence Report: US Department of Health and Human Services, Public Health Service, NIH, HHLBI. Bethesda, Md; June 1998.
4. Vartanian L, Schwartz M, Brownell K. Effects of soft drink consumption on nutrition and health: a systematic review and meta-analysis. Am J Publ Hlth. 2007; 97: 667-675.
5. Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę. Stanowisko Polskiego Towarzystwa Diabetologicznego. Diabetologia Pol 2008; 8 (Supl. A): 11-12.
6. McAuley K, Wiliams S, Mann J, Goulding A, Chisholm A, Wilson N, Story G, McLay R, Harper M, Jones L. Intensive lifestyle changes are necessary to improve insulin sensitivity: a randomised controlled trial. Diabetes Care 2002; 25: 445-452.
7. Uusitupa M, Lindi V, Louheranta A, Salopuro T , Lindström J, Tuomilehto J. For the Finnish Diabetes Prevention Study Group. Long-Term Improvement in Insulin Sensitivity by Changing Lifestyles of People with Impaired Glucose Tolerance 4-Year Results From the Finnish Diabetes Prevention Study. Diabetes 2003; 52: 2532-2538.
8. Lindström J, Louheranta A, Mannelin M, Rastas M, Salminen V, Eriksson J, Uusitupa M, Tuomilehto J. For the Finnish Diabetes Prevention Study Group. The Finnish Diabetes Prevention Study (DPS). Lifestyle intervention and 3-year results on diet and physical activity. Diabetes Care 2003; 26: 3230-3236.
9. Tuomiletho J, Lindström J, Eriksson J. For the Finish Diabetes Prevention Program. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001, 344: 134-1350.
10. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2003; 346: 393-403.
11. Van der Bruggen M, Bos G, Bemelmans W, Hoogenveen R, Vijgen S, Baan C. Lifestyle interventions are cost-effective in people with different levels of diabetes risk. Results from a modelling study. Diabetes Care 2007; 30: 128-134.
12. Wing R, Goldstein M, Acton K, Birch L, Jakicic J, Sallis J, Smith-West D, Jeffery R, Surwit R. Behavioural Science Research in Diabetes. Lifestyle changes related to obesity, eating behavioural and physical activity. Diabetes Care 2001, 24: 117-123.
13. Wadden TA, Sternberg JA, Letizia KA, Stunkard 42 K. Cyganek AJ, Foster GD. Treatment of obesity by very low calorie diet, behavior therapy, and their combination: a fiveyear perspective. Int J Obes 1989; 13 (Suppl 2): 39-46. 14. Tsai AG, Wadden TA. Systematic review: an evaluation of major commercial weight loss programs in the United States. Ann Intern Med. 2005; 142: 56-66.
15. Dansinger M, Gleason J, Giffthe J, Selker H, Schaefer E. Comparison of the Atkins, Ornish, Weight Watchers and Zone diets for weight loss and heart disease risk reduction. JAMA 2005; 292: 43-53.
16. Leibel R, Rosenbaum M, Hirsch J. Changes in energy expenditure resulting from altered body weight. N Engl J Med 1995; 332: 621-628.
17. Redmon B, Reck K, Raatz S, Swanson J, Kwong C, Ji H, Thomas W, Bantle J. Two-Year Outcome of a Combination of Weight Loss Therapies for Type 2 Diabetes. Diabetes Care 2005; 28: 1311-1315.
18. Pi-Sunyer X. The role of weight loss in improving metabolic outcoms. Clinical Update, Medscape 2002, 3: 1-15.
19. Lamotte M, Annemans L, Lefever A, Nechelput M, Masure J. A health economic model to assess the longterm effects and cost-effectiveness of orlistat in obese type 2 diabetic patient. Diabetes Care 2001; 25: 303- 308.
dr med.Katarzyna Cyganek
Katedra i Klinika Chorób Metabolicznych Collegium Medicum Uniwersytet Jagielloński, Kraków
ISSN 1732-0224
ZESPÓŁ METABOLICZNY – POJĘCIE, PATOFIZJOLOGIA, DIAGNOSTYKA I LECZENIE
Stosunkowo niedawno spopularyzowane pojęcie zespołu metabolicznego ma już jednak swoją dość długą historię. Na pierwszym Kongresie Europejskiego Towarzystwa Badań nad Cukrzycą (EASD, European Association for the Study of Diabetes) Avogaro i Crepaldi użyli określenia „zespół plurimetaboliczny” dla sytuacji kojarzenia się otyłości brzusznej, nadciśnienia tętniczego, dyslipidemii i zaburzeń gospodarki węglowodanowej, stanowiącej zagrożenie chorobą niedokrwienną serca [1]. Kaplan opisywał podobny zestaw cech ryzyka choroby wieńcowej i przyspieszonego zgonu sercowego, używając barwnej nazwy „śmiertelny kwartet” [2]. Właściwie jednak na aspekt czynników ryzyka miażdżycy szerzej spojrzał Reaven. Uznał on, że współwystępowanie 6 czynników (tab. 1) istotnie zwiększa ryzyko zgonu sercowego i nazwał to, ze względu na niejasne jeszcze wtedy wzajemne związki, zespołem X [3]. W pojęciu zespołu X po raz pierwszy pojawiło się znaczenie hiperinsulinemii i insulinooporności jako istotnych elementów składowych tego zespołu, decydujących o formowaniu się innych cech tego zespołu, jak: zaburzenia gospodarki węglowodanowej, dyslipidemia, nadciśnienie tętnicze, prowadzących do przyspieszonego rozwoju choroby niedokrwiennej serca. Wtedy jeszcze nie precyzowano wzajemnej roli hiperinsulinemii i insulinooporności — obecnie wiadomo, że ta druga generuje kompensacyjny wzrost tej pierwszej. Wychodząc z tych założeń, nazywano roboczo zespół metaboliczny zespołem insulinooporności. Lista elementów składowych zespołu metabolicznego od czasu publikacji Reavena ulegała wydłużaniu, często inkorporując cechy, które raczej są wskaźnikami zespołu niż jego składowymi (np. mikroalbuminuria) (tab. 2). Kres bogatemu nazewnictwu (zespół X, zespół plurimetaboliczny, polimetaboliczny, metaboliczny zespół X, zespół insulinooporności [4, 5]) położyła publikacja Światowej Organizacji Zdrowia (WHO, World Health Organization) [6], nazywając omawiany zespół zespołem metabolicznym i taką nazwę należy obecnie stosować.
Należy również podkreślić fakt, że zespół metaboliczny jest bardzo poważnym problemem publicznej opieki zdrowotnej. Ocenia się, że w Europie dotyczy on ponad 16% populacji dorosłych. W szczególnych grupach etnicznych pojawia się jeszcze częściej. Jako zestaw czynników zagrożenia miażdżycą dotyczy on także w coraz większym odsetku dziecii młodzieży [7, 8].
| Tabela 1. Klasyczny zestaw składowych zespołu metabolicznego wg Reavena [3] |
|---|
| Hiperinsulinemia |
| Insulinooporność |
| Upośledzona tolerancja glukozy |
| Dyslipidemia |
| Nadciśnienie tętnicze |
| Choroba wieńcowa |
| Tabela 2. Zestaw elementów włączanych do zespołu metabolicznego |
|---|
| Insulinooporność |
| Hiperinsulinemia |
| Upośledzony metabolizm glukozy lub cukrzyca typu 2 |
| Hipertriglicerydemia |
| ▲ cholesterolu frakcji LDL |
| ▼ cholesterolu frakcji HDL |
| Otyłość androidalna |
| Nadciśnienie tętnicze |
| ▲ aktywności osi podwzgórze-przysadka-nadnercza |
| Hiperfibrynogenemia |
| Zaburzenia fibrynolizy |
| ▼ stężenie homocysteiny |
| Mikroalbuminuria |
| Dna |
| Wiek |
| Choroba wieńcowa |
Patofizjologia zespołu metabolicznego
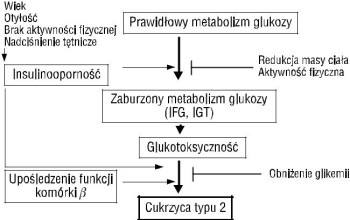
Na rycinie 1 przedstawiono koncepcję roli i znaczenia relacji między insulinoopornością i sekrecją insuliny w generowaniu cukrzycy typu 2 i zespołu metabolicznego. W cukrzycy typu 2 oba czynniki patofizjologiczne: insulinooporność i defekt wydzielania insuliny — odgrywają równie istotną rolę. Pomijając dyskusję, czy pierwotny jest defekt wydzielania insuliny, czy insulinooporność oraz czy insulinooporność jest zjawiskiem stałym lub narastającym, można stwierdzić, że w cukrzycy typu 2 po pewnym czasie dochodzi do załamania się kompensacyjnej sekrecji insuliny i do hipoinsulinemii oraz wyraźnej hiperglikemii. W zespole metabolicznym przez cały okres obserwacji albo jeszcze przed wystąpieniem cukrzycy mamy do czynienia z kompensacyjnym zwiększonym wydzielaniem insuliny. To wydzielanie równoważy istniejąca pierwotnie insulinooporność, stabilizując jednak negatywne skutki zarówno hiperinsulinemii, jak i nieznacznie podwyższonej glikemii najczęściej na poziomie nieprawidłowej glikemii na czczo (IFG, impaired fasting glucose). Związek insulinooporności, umiarkowanych zaburzeń gospodarki węglowodanowej, znaczenia glukotoksyczności z nich wynikającej oraz ich roli w rozwoju cukrzycy i makroangiopatii ilustruje rycina 2.
Nawet graniczne zaburzenia gospodarki węglowodanowej (IGT — impaired glucose tolerance, IFG) upośledzają funkcję komórek B i nasilają insulinooporność, przyspieszając rozwój cukrzycy. Po dłuższym czasie zaburzenia te łącznie z hipersekrecją insuliny sprzyjają rozwojowi nadciśnienia tętniczego, miażdżycy naczyń wieńcowych i zwiększeniu śmiertelności sercowo-naczyniowej [9].
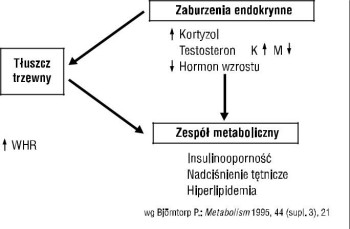
W patogenezie zespołu metabolicznego przypisuje się istotną rolę zaburzeniom osi podwzgórze-przysadka-nadnercza. Bjorntorp [10] uważa nawet, że ta oś ma znaczenie inicjujące rozwój otyłości trzewnej, insulinooporności, zaburzeń produkcji triglicerydów przez wątrobę oraz przyspiesza rozwój miażdżycy (ryc. 3).
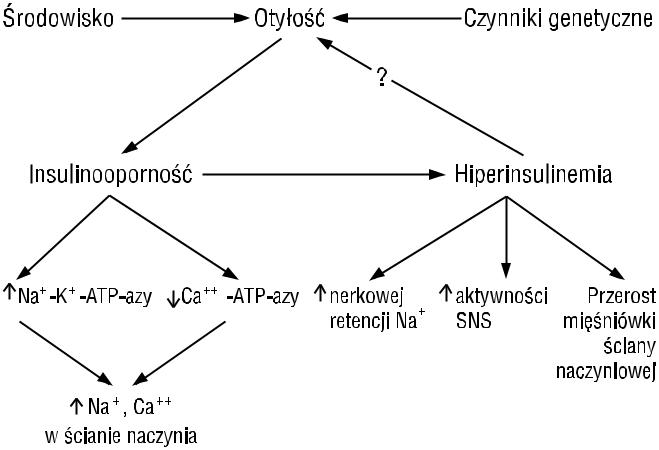
Niewątpliwie bardzo istotnym i decydującym o dynamice zespołu metabolicznego czynnikiem jest obecność nadciśnienia tętniczego. Związek nadciśnienia tętniczego z dyslipidemią, otyłością trzewną i opornością na insulinę udowodniono w wielu publikacjach, zarówno na podstawie zależności wzrastającego średniego dobowego ciśnienia tętniczego i malejącej wrażliwości na insulinę, jak i w prostych pomiarach zależności między ciśnieniem tętniczym a stężeniem insuliny na czczo jako miarą insulinooporności. Mechanizmy związku hiperinsulinemii ze wzrostem ciśnienia tętniczego są wielorakie, co ilustruje rycina 4. Należy zwrócić szczególną uwagę na aktywację układu adrenergicznego. Szczególne znaczenie Reaven przypisuje właśnie obniżonemu metabolizmowi glukozy, pobudzającemu aktywność współczulnego układu nerwowego autonomicznego [11].
Bardzo istotnym, aczkolwiek nie niezbędnym elementem składowym zespołu metabolicznego jest otyłość, zwłaszcza otyłość brzuszna. Wyraźnie udowodniono związek zwiększonej insulinooporności ze wzrostem masy ciała. Jednak związek ten nie musi się sprowadzać do samego wzrostu wskaźnika masy ciała (BMI, body mass index). Istotniejsze znaczenie ma wykazanie otyłości brzusznej, a czasem nawet, przy prawidłowej masie ciała, takiego rozłożenia tkanki tłuszczowej, w którym przeważa tkanka trzewna. Dlatego w tych sytuacjach poza prostym pomiarem wskaźnika talia/biodra (WHR, weist to hip ratio) przydatne może być precyzyjniejsze określenie ilości tkanki tłuszczowej trzewnej na podstawie tomografii komputerowej, rezonansu magnetycznego czy metodą densytometryczną [12].
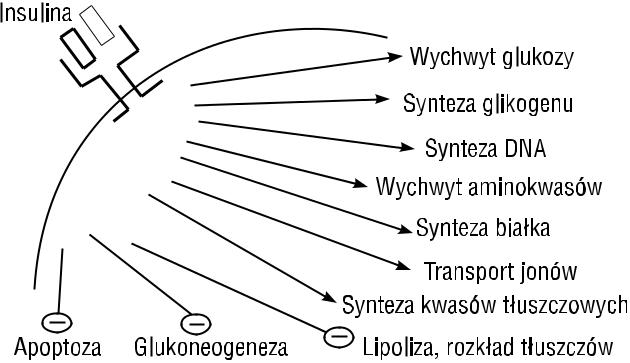
U podstaw patogenetycznych zespołu metabolicznego znajduje się, jak podkreślano, insulinooporność. Poza czynnikami zewnętrznymi, środowiskowymi powodującymi obniżenie wrażliwości na insulinę, jak nadwaga czy otyłość i zmniejszona aktywność fizyczna, istotną rolę odgrywają czynniki genetyczne. Insulina, jak wiadomo hormon anaboliczny, wywołuje efekt metaboliczny, łącząc się ze swoistym receptorem, a po jego przekształceniu i internalizacji wywołuje liczne efekty postreceptorowe, uruchamiające wiele „linii metabolicznych” (ryc. 5). Każdy z tych procesów regulowanych przez insulinę, a sprowadzających się do aktywacji kaskady białek czynnościowych lub regulatorowych, może być, wskutek genetycznie uwarunkowanego defektu, źródłem obniżenia wrażliwości na insulinę. W ten sposób genami — kandydatami insulinooporności — mogą być geny odpowiedzialne za strukturę samego receptora, substratów receptora, szlaków metabolicznych i białek regulatorowych syntezy transporterów glukozy, enzymów glikolizy, glikogenosyntezy, regulacji procesów stymulacji replikacji DNA itp. [13].
Ostatnio w piśmiennictwie najwięcej uwagi i wysiłku badawczego poświęcono jednak kilku takim genom — kandydatom. Szczegółowo badano polimorfizmy genu kalpainy. Wykazano istnienie statystycznie znamiennego polimorfizmu sprzyjającego (zależność znamienna statystycznie) rozwojowi cukrzycy typu 2 i insulinooporności, choć badania ograniczały się z reguły do wybranych populacji [14–16]. Drugim kierunkiem są badania polimorfizmów w zakresie genów receptorów aktywowanych proliferacją peroksysomu (PPAR, peroxysome proliferator activator receptor), wśród których wykazano polimorfizmy sprzyjające [ABCC8(Exon 22)C/T]i chroniące (PRO12ALA) przed insulinoopornością. Również i w tej grupie genów uzyskano pewne różnice statystyczne w grupach otyłości, insulinooporności i cukrzycy typu 2, badając różne populacje [17]. Ten nurt badań polimorfizmów genów receptorów PPAR jest szczególnie istotny, ponieważ syntetyzowane są leki działające na te receptory, na przykład fibraty, głównie na PPAR a czy tiazolidinediony na receptory PPARg. Obecnie trwa poszukiwanie miejsc działania leków hipoglikemizujących czy przeciwhiperglikemicznych właśnie na mechanizmy insulinooporności. Przykładem są tutaj próby przypisania metforminie działania na białka transportujące glukozę, a niektórym pochodnym sulfonylomocznika wpływu na syntezę glikogenu (gliklazyd) [18] czy na procesy przezbłonowego transportu glukozy zarówno przy udziale insuliny, jak i poza tym udziałem (glimepiryd) [19, 20].
Omawiając badane mechanizmy insulinoopor ności, należy też wspomnieć o rezystynie zwiększającej insulinooporność [21], która prawdopodobnie okaże się wcześniej opisanym białkiem FI223 [22]. Ostatnio zainteresowanie wzbudza badane także pod kątem regulacji zachowań pokarmowych białko tanis. Gen tego białka został zlokalizowany na chromosomie 15 (15q26), a sama substancja ma reagować na stan sytości i karmienia oraz współregulować wrażliwość na insulinę [23].
Oczywiście wymienione tutaj geny nie wyczerpują listy genów — kandydatów insulinooporności. Ciągle jednak pozostaje otwarte pytanie o gen czy geny odpowiedzialne za znaczny odsetek przypadków obniżonej wrażliwości na insulinę [24].
Oprócz tła genetycznego duże uznanie w poszukiwaniach etiologii zespołu metabolicznego przypisywano czynnikom wrodzonym (thrifty phenotype w przeciwieństwie do thrifty genotype), wynikającym z niskiej masy urodzeniowej [24]. W dojrzałym wieku adaptacja układów regulacyjnych do kompensacji niskiej urodzeniowej masy ciała ma prowadzić do nadmiernego rozwoju insulinooporności, otyłości trzewnej i innych elementów zespołu metabolicznego [25, 26].
Rycina 1. Znaczenie relacji między insulinoopornością i sekrecją insuliny w generowaniu zespołu metabolicznego
Rycina 2. Przejście od prawidłowej glikemii do cukrzycy typu 2; IFG — nieprawidłowa glikemia na czczo; IGT — upośledzona tolerancja glukozy
Rycina 3. Zaburzenia osi podwzgórze-przysadka-nadnercza a zespół metaboliczny; WHR — wskaźnik talia/biodra
Rycina 4. Związek insulinooporności i hiperinsulinemii z nadciśnieniem tętniczym [21]
Rycina 5. Efekty działania insuliny na poziomie komórek
Diagnostyka zespołu metabolicznego
Zespół metaboliczny nie jest już tylko pojęciem patofizjologicznym. Jest to wyraźna sytuacja kliniczna, która obok określonej patogenezy, ma także cechy umożliwiające rozpoznanie, ocenę rokowania i metod leczenia oraz cechy warunkujące rozwój powikłań. Wbrew pozorom diagnostyka zespołu metabolicznego nie jest bardzo trudna i sofistyczna.
Obecnie wiadomo, że czynnikiem patogenetycznym, z którym łączy się wiele innych elementów prowadzących do szybszego rozwoju miażdżycy, zwłaszcza naczyń, jest insulinooporność. Samą insulinooporność trudno jest jednak zdiagnozować metodami klinicznymi. Dlatego poszukuje się zestawu badań, które umożliwiłyby rozpoznanie zespołu metabolicznego. Bardzo istotny postęp w tym zakresie wprowadziła w 1999 roku WHO, która ściśle określiła warunki rozpoznania zespołu metabolicznego, sankcjonując jednocześnie taką właśnie nazwę zespołu insulinooporności [6]. W tabeli 3 przedstawiono kryteria zespołu metabolicznego podane przez WHO. Na podstawie tego zestawienia niezbędne do rozpoznania są dwa główne kryteria zespołu metabolicznego oraz spełnienie dodatkowo dwóch z czterech drugorzędnych cech, aby rozpoznanie było pełne. Pewną trudność dla praktyków może stanowić określenie insulinooporności. Jak wiadomo, podstawowe znaczenie ma badanie metodą klamry euglikemicznej, raczej zarezerwowaną do badań poznawczych, choćby z uwagi na czasochłonność i koszt. Warto zwrócić uwagę, że bardzo dobrym narzędziem w tym zakresie był Biostator wyposażony w specjalny program. Szkoda, że w ostatnich latach zarzucono w Polsce badania z zastosowaniem tego urządzenia, które początkowo tak obiecująco się rozwijały [28, 29]. Bardzo przydatne i szeroko stosowane są metody do oceny wrażliwości na insulinę na podstawie różnych relacji glikemii i insulinemii. Najbliżej praktycznego zastosowania jest użycie do oceny insulinooporności oznaczania stężenia insuliny naczczo. Na celowość tego badania wskazywano już wcześniej [30]. Na rycinie 6 przedstawiono wartości insulinemii na czczo u osób zdrowych oraz z otyłością i różnego stopnia zaburzeniami gospodarki węglowodanowej. Widoczny jest wzrost insulinemii na czczo w otyłości, wskazujący na insulinooporność niezależnie od stopnia zaburzeń gospodarki węglowodanowej. Tak więc, oznaczanie insulinemii w celu oceny stanu zaburzeń gospodarki węglowodanoweji insulinooporności nie jest metodą nową. Obecnie można wykorzystać walory tego oznaczenia, zwłaszcza że nie trzeba się posługiwać kłopotliwymi metodami izotopowymi. Europejska Grupa do Badań nad Insulinoopornością (European Group for the Study of Insulin Resistance) [31] określiła własne kryteria insulinooporności, które przedstawiono w tabeli 4.Według tej grupy kluczowe znaczenie w określaniu insulinooporności ma właśnie pomiar insulinemii na czczo. Wydaje się więc sensowne wykorzystanie pomiaru insulinemii w celu spełnienia jednego z dwóch głównych kryteriów definicji zespołu metabolicznego podanej w publikacji WHO [6]. Pozostałe punkty tej definicji stanowią po prostu elementy składowe zespołu metabolicznego. Należy także podkreślić, że do rozpoznania zespołu metabolicznego nie jest konieczna obecność wszystkich składowych zespołu, co umożliwia częstsze jego rozpoznawanie. W definicji WHO nie wzięto pod uwagę wszystkich elementów wymienianych w piśmiennictwie jako składowe tego zespołu. Wydaje się, że zestaw tych drugorzędnych kryteriów będzie jeszcze podlegał weryfikacji.
Ostatnio opublikowano amerykańskie kryteria rozpoznawania zespołu metabolicznego (tab. 5). Nie zawierają one zupełnie odniesienia do stężenia insuliny ani do pomiaru insulinowrażliwości, oceniają tylko fakt istnienia insulinooporności na podstawie zestawu innych cech fenotypowych zespołu metabolicznego [32].
Ogłoszenie przez WHO kryteriów rozpoznania zespołu metabolicznego pociąga za sobą ważne skutki kliniczne. W działalności lekarskiej bowiem rozpoznanie służy zasadniczemu celowi, jakim jest postępowanie lecznicze. W wytycznych WHO nie ma wskazówek terapeutycznych, niemniej jednak należy podjąć próbę ich sformułowania, aby ocenić możliwości interwencyjne i zakres tej interwencji terapeutycznej. W tabeli 6 zestawiono potencjalne możliwości działań terapeutycznych po rozpoznaniu zespołu metabolicznego.
W leczeniu zespołu metabolicznego nie budzi wątpliwości interwencja w zakresie zmian stylu życia i diety. Postępowanie takie ma znaczenie w prewencji cukrzycy. Ostatnio opublikowane wyniki badania Tuomilehto i wsp., dotyczące zmniejszenia zapadalności na cukrzycę w grupie ryzyka poddanej intensywnej redukcji masy ciała i zwiększonej aktywności fizycznej, stanowią podstawę do wdrożenia tego postępowania także w leczeniu zespołu metabolicznego [33]. Słabym punktem tego badania jest fakt, że nieprawidłową tolerancję glukozy rozpoznawano oczywiście na podstawie testu doustnego obciążenia glukozą, ale badanie wykonywano u osób z glikemią na czczo dopiero powyżej 140 mg/dl. W ten sposób u części osób rozpoznano nietolerancję glukozy, mimo że według aktualnych kryteriów (> 125 mg/dl na czczo) osoby te miały już cukrzycę. Nie była to więc u nich prewencja, ale interwencja terapeutyczna. Podobne próby oceny znaczenia zmiany stylu życia w prewencji cukrzycy typu 2 podejmowano zresztą już wcześniej [34, 35], wykazując także skuteczność tego postępowania. Badanie chińskie Da Qing było tylko częściowo randomizowane, wykazało jednak korzystny wpływ zmiany stylu życia [35].
Oczywiste i celowe jest także leczenie nadciśnienia tętniczego do osiągnięcia wartości uważanej obecnie za kryterium wyrównania cukrzycy według American Diabetes Association, czyli poniżej 130/80 mm Hg [36]. Dyskusyjny jest już jednak problem stosowania leków hipotensyjnych, jeśli nie stwierdza się nadciśnienia. Pewną pomocą może być tutaj analiza rytmu dobowego ciśnienia tętniczego oraz stwierdzenie na przykład mikroalbuminurii, która może być wskazaniem do stosowania inhibitorów konwertazy angiotensyny mimo prawidłowych wartości ciśnienia tętniczego. Należy także podkreślić znaczenie stosowania leków hipolipemizujących, jeżeli są wskazane w związku z zaburzeniami lipidowymi i nieskutecznością odpowiedniej diety.
Natomiast wciąż kontrowersyjne i dyskusyjne może być wprowadzanie farmakoterapii z zastosowaniem leków hipoglikemizujących. Szczególnie przydatne w zakresie obniżenia insulinooporności wydają się tutaj leki o mechanizmie nastawionym na poprawę obwodowego działania insuliny czy też na korygowanie ewentualnych defektów jej wydzielania we wczesnej fazie, która może być upośledzona jeszcze w warunkach hiperinsulinemii wynikającej z przedłużonej drugiej fazy. Teoretycznie można by tutaj myśleć o szybkodziałających preparatachz grupy glinidów (repaglinid, mitiglinid) lub wolno uwalniających się preparatach „na żądanie” (gliklazyd MR, glipizyd GITS, glimepiryd), lecz w zespole metabolicznym nie są te zastosowania sprawdzone i zawsze niosą ryzyko zwiększenia hiperinsulinemii.
Bardziej praktyczne i z punktu widzenia patofizjologii zespołu metabolicznego bardziej uzasadnione wydaje się zastosowanie metforminy lub tiazolidinedionów. Metformina nie zwiększa sekrecji insuliny, a poprzez swój mechanizm zwiększający wrażliwość na insulinę wydaje się obecnie najwłaściwszym kandydatem do ewentualnego zastosowa nia u osób z insulinoopornością. Skuteczność metforminy w warunkach insulinooporności została sprawdzona na przykład w leczeniu zespołu policystycznych jajników [37]. Wykazano w tych przypadkach nie tylko poprawę w zakresie profilu hormonów płciowych, ale także normalizację takich elementów składowych zespołu metabolicznego, jak plazminogen, lipoproteina (a), stężenie insuliny i wreszcie, co najważniejsze, poprawę samej wrażliwości na insulinę [38, 39]. Metformina wykazuje również korzystny wpływ redukujący masę ciała, a także na obniżenie ciśnienia tętniczego, działa więc kompleksowo na kilka istotnych składowych zespołu metabolicznego [40, 41].
Drugą grupą leków nastawioną na mechanizm zwiększonej insulinooporności są tiazolidinediony. Leki te, działając na jądrowe receptory aktywowane proliferacją peroksysomu gamma (PPARg), poprawiają obwodowy efekt insuliny. Pewna rezerwa do tej grupy leków wiąże się z niepowodzeniami w terapii troglitazonem, który okazał się wyraźnie hepatotoksyczny. Nie wykazują tego działania inne preparaty z tej grupy, jak pioglitazon i roziglitazon, który wydalany jest w głównej mierze przez nerki.
Otwarte pozostaje pytanie, czy leki sprawdzone w leczeniu jawnej cukrzycy (metformina, tiazolidinediony) należy stosować w jej prewencji, jaką jest leczenie insulinooporności w zespole metabolicznym. Amerykański program prewencji cukrzycy (DPP–42), zawierający między innymi kierunki postępowania z zastosowaniem metforminy i troglitazonu, w części dotyczącej tego ostatniego został wstrzymany właśnie ze względu na wycofanie troglitazonu przez amerykańską FDA (Food and Drug Administration). Wczęści dotyczącej jedynie modyfikacji stylu życia,
a także zastosowania metforminy prewencja była skuteczna. Interesujący jest fakt, że efekty prewencyjne zmian stylu życia (7-procentowa redukcja masy ciała m.in. poprzez codzienny 30-minutowy wysiłek fizyczny) były wyraźniejsze niż efekty stosowania metforminy. Ta ostatnia była skuteczniejsza u osób młodszych, natomiast skuteczność zmiany stylu życia była najefektywniejsza u osób w starszym wieku (>70 lat). W całym programie zmniejszenie zapadalności na cukrzycę wyniosło po 3 latach w grupie z zastosowaniem metforminy 31%, a w grupie z interwencją w postaci zmiany stylu życia aż 58%, czyli podobnie jak w badaniu fińskim [43].
Ostatnio pojawiły się jeszcze wyniki dwóch programów prewencji cukrzycy, a więc, inaczej mówiąc, leczenia zespołu metabolicznego. Badanie STOP-NIDDM przy zastosowaniu akarbozy wykazało 25-procentową redukcję wystąpienia cukrzycy u osób z nieprawidłową tolerancją glukozy [44]. Badanie XENDOS z zastosowaniem orlistatu u osób z otyłością wykazało również skuteczność w zapobieganiu rozwojowi cukrzycy wyrażającą się zmniejszeniem ryzyka o 37% [45]. Zmniejszenie ryzyka dotyczyło zarówno przejścia nieprawidłowej tolerancji glukozy w jawną cukrzycę, jak i przejścia od prawidłowej do nieprawidłowej tolerancji glukozy. Wyniki czterech głównych ostatnio ogłoszonych badań dotyczących prewencji cukrzycy przedstawiono w tabeli 7.
Omawiając działania dotyczące profilaktyki cukrzycy, a więc leczenia zespołu metabolicznego, należy postawić pytanie, w jakim stopniu rzeczywiście jest to prewencja, a w jakim tylko odsunięcie w czasie wystąpienia jawnej postaci cukrzycy typu 2 [46, 47]. W klasycznym rozumieniu prewencję określa się na przykład jako przeprowadzenie szczepienia przeciw ko chorobie zakaźnej, które zabezpieczy nas na zawsze lub na długo pomimo ekspozycji na to schorzenie. W przypadku cukrzycy sytuacja jest odmienna — usuwa się ekspozycję poprzez likwidację na przykład otyłości czy małej aktywności fizycznej. Nie odpowiedziano na to pytanie, ponieważ nie było długoterminowych badań dotyczących zapadalności na Jacek Sieradzki, Zespół metaboliczny — pojęcie, patofizjologia, diagnostyka i leczenie 193Diabetologia Praktyczna 2002, tom 3, nr 4 cukrzycę typu 2 w miarę trwania wieloletniej interwencji. Nie przeprowadzono też badań dotyczących analizy zapadalności po przerwaniu programu prewencyjnego. Wyjątkiem jest tutaj ocena zapadalności na cukrzycę typu 2 kobiet po przebytej cukrzycy ciężarnych przy stosowaniu troglitazonu. Stosowanie leku przerwano po wycofaniu go z lekospisu, jednak kilka miesięcy po zakończeniu programu oceniono trend zapadalności, wykazując utrzymywanie się zmniejszonej zapadalności, jaką osiągnięto w okresie stosowania troglitazonu [48]. Nie ma, jak dotychczas, programów prewencyjnych z zastosowaniem innych glitazonów.
Należy również postawić pytanie dotyczące terapii zespołu metabolicznego, głównie zmiany stylu życia, w jakim stopniu doświadczenia z precyzyjnie przeprowadzonego eksperymentu klinicznego, w którym badacze są uzbrojeni w możliwości bardzo intensywnego nacisku i wyposażeni dzięki odpowiednim środkom finansowym w bardzo energiczną pomoc dietetyków, kinezyterapeutów czy specjalistów od aerobiku, można przenieść na szerokie populacje osób w codziennej praktyce ambulatoryjnej. Doświadczenie uczy, że przeniesienie tych doświadczeń może być trudne. Z drugiej strony powstaje pytanie o regulacje prawne dotyczące stosowania leków hipoglikemizujących lub przeciwhiperglikemicznych u osób bez jawnej cukrzycy. Wymaga to nowych procedur rejestracyjnych.
Pomimo tych pytań należy stwierdzić, że udowodniono, iż cukrzycy typu 2 można zapobiegać, a jeśli nie, to odsunąć w czasie jej wystąpienie w istotnym statystycznie odsetku przypadków. W programie fińskim 5 lat prewencji według stosowanego modelu u 5 osób daje szansę prewencji cukrzycy u 1 osoby [47]. W wypadku programu DPP u 14 osób prewencja przez 3 lata przynosi efekt u 1 osoby [47].
Z praktycznego więc punktu widzenia farma koterapię z zastosowaniem leków poprawiających wrażliwość na insulinę należałoby wdrożyć w tych przypadkach zespołu metabolicznego, w których nie udało się uzyskać poprawy przy stosowaniu postępowania behawioralnego. Powinno to dotyczyć zwłaszcza osób, u których istnieje rodzinne obciążenie rozwijającą się w relatywnie młodym wieku, miażdżycą, zwłaszcza pod postacią zaawansowanej choroby wieńcowej, zawału serca, udaru czy miażdżycy kończyn dolnych. W takiej sytuacji trudno jest zbyt długo czekać na wątpliwy w tych przypadkach efekt diety i wysiłku fizycznego i powinno się jak najszybciej chronić pacjenta przed skutkami insulinooporności, mimo że nie rozwinęła się jawna cukrzyca.
| Tabela 3. Kryteria rozpoznania zespołu metabolicznego (wg Raportu Grupy Konsultacyjnej WHO [6]) |
|---|
| 1. Upośledzenie regulacji metabolizmu glukozy lub cukrzyca (wg kryteriów WHO [6]) i/lub |
| 2. Insulinooporność (wychwyt glukozy poniżej najniższego kwartyla populacji) oraz dwie ze składowych: |
| — nadciśnienie tętnicze (≥ 140/90 mm Hg) |
| — stężenie triglicerydów ≥ 17 mmol/l (150 mg/dl), cholesterolu frakcji HDL < 0,9 mmol/l (35 mg/dl) u mężczyzn i < 1,0 mmol/l (39 mg/dl) u kobiet |
| — otyłość centralna (WHR > 0,90 u mężczyzn i > 0,85 u kobiet) i/lub BMI > 30 kg/m 2 |
| — mikroalbuminuria (≥ 20 mg/min lub albuminuria: kreatynina ≥ 30 mg/g) |
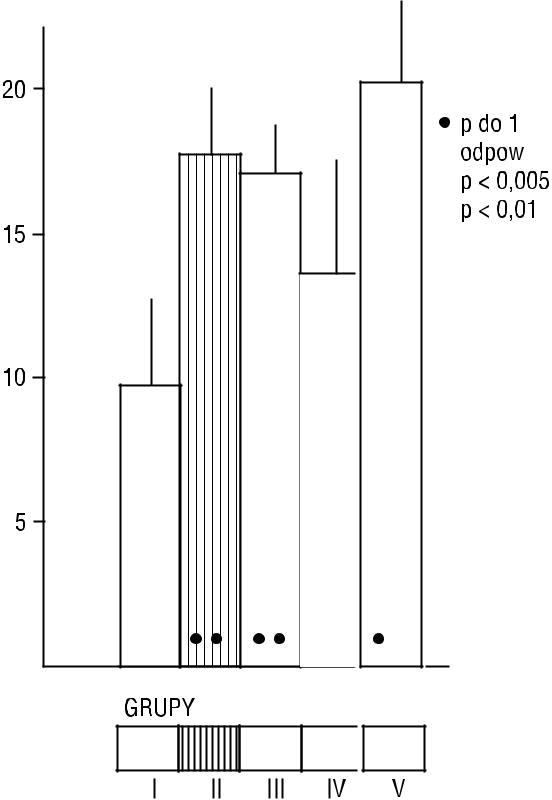
Rycina 6. Insulinemia na czczo (średnia z 4 oznaczeń) w grupie kontrolnej (I), otyłości z prawidłową tolerancją glukozy (II), otyłości z nieprawidłową tolerancją glukozy (III), otyłości ze świeżo wykrytą cukrzycą typu 2 (IV) i otyłości z cukrzycą typu 2 leczoną pochodnymi sulfonylomocznika (V) (wg [30])
| Tabela 4. Kryteria zespołu insulinooporności dla osób niechorujących na cukrzycę (wg European Group for the Study of Insulin Resistance 1999) |
|---|
| Stężenie insuliny na czczo w górnych 25% przedziału dla populacji oraz dwa z następujących elementów: |
| — glikemia > 6,1 mmol/l |
| — RR ≥ 140/90 mm Hg |
| — triglicerydy > 2,0 mmol/l lub cholesterol frakcji HDL < 1,0 mmol/l |
| — obwód talii: mężczyźni > 94 cm, kobiety > 80 cm |
RR — nadciśnienie tętnicze
| Tabela 5. Kliniczne cechy zespołu metabolicznego według Narodowego Programu Edukacji Cholesterolowej Stanów Zjednoczonych. Rozpoznanie zespołu metabolicznego na podstawie trzech nieprawidłowości | |
|---|---|
| Czynnik ryzyka | Poziom rozpoznawczy |
| Otyłość brzuszna | Obwód talii |
| Mężczyźni | > 102 cm |
| Kobiety | > 88 cm |
| Triglicerydy | ≥ 150 mg/dl |
| Cholesterol frakcji HDL | |
| Mężczyźni | < 50 mg/dl |
| Kobiety | < 50 mg/dl |
| Ciśnienie tętnicze | ≥ 130/ ≥ 85 mm Hg |
| Glikemia na czczo | ≥ 110 mg/dl |
| Tabela 6. Możliwości terapeutyczne w leczeniu zespołu metabolicznego |
|---|
| A. Postępowanie niefarmakologiczne |
| 1. Dieta |
| 2. Aktywność fizyczna |
| 3. Redukcja masy ciała |
| B. Postępowanie farmakologiczne |
| 1. Leki hipotensyjne |
| 2. Leki hipolipemizujące |
| 3. Leki zmniejszające insulinooporność (?) |
| 4. Leki poprawiające posiłkową regulację glikemii (?) |
| Tabela 7. Duże badania dotyczące prewencji cukrzycy | |||||||
|---|---|---|---|---|---|---|---|
| Badanie | Liczba badanych | Postępowanie | Czas badania (lata) | Wiek badanych (lata) | Średni wskaźnik masy ciała [kg/m2] | Średnia glikemia na czco [mg/dl] | Redukcja ryzyka wystąpienia cukrzycy |
| DPP | 3234 | Placebo/metformina/zmiana stylu życia | 2,8 | 51 | 34 | 106 | 58% styl życia) 31% (metformina) |
| Finnish
Diab. Prev. |
522 | Zmiana stylu życia/konwencjonalne poradnictwo | 3,2 | 55 | 31 | 110 | |
| STOP-NIDDM | 1429 | Placebo/akarboza | 3,3 | 55 | >31 | 101-139 | 25% (akarboza) |
| XENDOS | 3304 | Placebo + zmiana stylu życia/orlistat + zmiana stylu życia | 4 | 30-60 | ≥30 | 37% (orlistat) | |
DPP — Diabetes Prevention Program
Podsumowanie
W świetle aktualnych danych można stwierdzić, że zespół metaboliczny jest pojęciem nie tylko patofizjologicznym, ale także praktyczno-klinicznym. Stwierdzenie takie implikuje konieczność jego diagnozowania i leczenia. Celom diagnostycznym służą obecnie proste kryteria i metody, które można zastosować w codziennej praktyce lekarskiej. Konsekwencją rozpoznania powinno być jednak podjęcie leczenia osób z zespołem metabolicznym. Bardzo ważne i niebudzące wątpliwości jest wdrożenie zmian stylu życia, które może być trudne do konsekwentnego przeprowadzenia u wielu pacjentów z zespołem metabolicznym. Nie budzi wątpliwości postępowanie farmakologiczne w leczeniu takich składowych zespołu metabolicznego, jak nadciśnienie tętnicze i dyslipidemia. Skuteczność farmakoterapii ukierunkowanej na insulinooporność została udowodniona w programach z zastosowaniem leków przeciwcukrzycowych. Wydaje się, że taką farmakoterapię w zespole metabolicznym należy wprowadzić, gdy nie osiąga się efektów zmian stylu życia u osób, które są zagrożone szybkim rozwojem miażdżycy. Dotyczy to szczególnie osób młodszych z potwierdzonym w tym kierunku wywiadem rodzinnym, gdy farmakoterapia jest jedynym rozwiązaniem chroniącym je przed rozwojem przedwczesnej miażdżycy, zawałem serca i cukrzycą typu 2.
PIŚMIENNICTWO
1. Avogaro P., Crepaldi G., Enzi G., Tiengo A.: Association of hyperlipidemia, diabetes mellitus and mild obesity. Acta Diabetol. Lat. 1967; 4: 572–590.
2. Kaplan N.M.: The deadly quartet: upper body obesity, glucose intolerance, hypertriglyceridemia and hypertension. Arch. Int. Med. 1989; 149: 1514–1520.
3. Reaven G.M.: Role of insulin resistance in human disease. Diabetes 1988; 37: 1595–1607.
4. Sieradzki J.: Zespół metaboliczny (zespół X). Diagnostyka Laboratoryjna 1993; 29: 249–254.
5. Sieradzki J.: Zespół polimetaboliczny. Czynniki Ryzyka 1997; 1–2: 25–30.
6. Definition, diagnosis and classification of diabetes mellitus and its complications. Report of a WHO Consultation. WHO Geneva 1999.
7. Lebovitz H.E.: The metabolic syndrome: unresolved issues. W: Occlusive arterial disease — the interfaces among dyslipidemias, hypertension and diabetes. Schwartz C.J., Born GVR Schattaner red. Stuttgart, New York 2001; 261–275.
8. Wabelea D., Imperatore G., Pettitt D.J. i wsp.: Birth weight, type 2 diabetes and insulin resistance in Pima Indian children and young adults. Diabetes Care 1999; 22: 944–950.
9. Despres J.P., Lamarche B., Mauriege P. i wsp.: Hyperinsulinemia as an independent risk factor for ischaemic heart diseases. NEJM 1996; 334: 952–957.
10. Bjorntorp P.: Visceral obesity: a „civilization syndrome”. Obesity Res. 1999; 1: 206–222.
11. Reaven G.M., Lithel H., Landsberg L.: Hypertension and associated metabolic abnormalities — the role of insulin resistance and the sympathoadrenal system. NEJM 1996; 334: 374–381.
12. Sieradzki J.: Otyłość a cukrzyca. Endokr. Pol. 2001; 52 (supl. 1): 227–239.
13. Moller D.E., Bjorbek C., Vidal-Puig A.: Candidate genes for insulin resistance. Diabetes Care 1996; 19: 396–400.
14. Horikawa Y., Oda N., Cox N.J. i wsp.: Genetic variation in the calpain 10 gene (CAPN10) is associated with type 2 diabetes mellitus. Nature Gen. 2000; 26: 163–168.
15. Małecki M.T., Moczulski D.K., Klupa T. i wsp.: Homozygous combination of calpain 10 gene haplotypes is associated with type 2 diabetes mellitus in a Polish population. Eur. J. Endocrinol. 2002; 146: 695–699.
16. Małecki M.T., Klupa T., Zub A., Cyganek K., Moczulski D.K., Sieradzki J.: Allelic variations in calpain 10, PPARg genes and risk of type 2 diabetes in Polish population. Diabetes 2001; 50: A243.
17. Altshuler D., Hirschhorn J.N., Klannemark M. i wsp.: The common PPARg Pro12Ala polymorphism is associated with decreased risk of type 2 diabetes. Nature Gen. 2000; 26: 76–79.
18. Johnson A.B., Argyraki M., Thow J.C. i wsp.: The effect of sulphonylurea therapy on secretion in newly presenting type 2 diabetic patients. Diabet. Med. 1991; 8: 243–246.
19. Sieradzki J.: Glimepiryd w terapii cukrzycy w świetle badań klinicznych. Diabetol. Prakt. 2001; 2 (supl. B): 9–13.
20. Muller G.: The molecular mechanism of the insulin — mimetic— sensitizing activity of the antidiabetic sulfonylurea drug Amaryl. Molec. Med. 2000; 6: 907–914.
21. Steppan C.M., Balley S.T., Brown E.J. i wsp.: The hormone resistin links obesity to diabetes. Nature 2001; 409: 307–312.
22. Savage D.B., Sewter C.P., Klenk E.S. i wsp.: Resistin/Fizz 3 expression in relation to obesity and peroxisome proliferator-activated receptor g action in humans. Diabetes 2001; 50: 2199–2202.
23. Collier G.: Transcriptional profiling as a tool for gene discovery in obesity. 9th Int. Congress on Obesity. Sao Paulo, VIII 2002.
24. Haffner S.M.: Syndrome X: insulin resistance — hyperinsulinemia the key? W: Hanefeld M., Leonhardt W. red. The Metabolic syndrome. Gustav Fisher, Jena 1997; 25–39.
25. Barker D.J.P., Hales C.N., Fall C.H.D. i wsp.: Type 2 (non-insulin-dependent) diabetes mellitus, hypertension and hyperlipidemia (syndrom X): relation to reduced fetal growth. Diabetologia 1993; 36: 62–67. 26. Mi J., Law C., Zhang K.L.: Effects of birth weight and maternal body mass index in pregnancy on components of the insulin resistance synfrome in China. Ann. Int. Med. 2000; 132: 253–260.
27. Byberg L., Mc Keigue P.M., Zethelius B.: Birth weight and the insulin resistance syndrome: Association of low birth weight with truncal obesity and raised plasminogen activator inhibitor I but not with abdominal obesity or plasma lipid disturbances. Diabetologia 2000; 43: 54–60.
28. Sieradzki J.: Metody infuzyjne w insulinoterapii. Pol. Tyg. Lek. 1986; 41: 323–326.
29. Sieradzki J., Szurkowska M.: Zastosowanie sterowanego glikemią dożylnego wlewu insuliny — Biostatora do optymalizacji insulinoterapii. Tzw. korygujące sprzężenie zwrotne. PAMW 1986; 75: 127–134.
30. Sieradzki J.: Zastosowanie oznaczania insuliny do oceny zabu rzeń gospodarki węglowodanowej w otyłości. Folia Med. Cracow. 1981; 23: 169–202.
31. Legro R.S., Finegood D., Dunaif A.: A fasting glucose to insulin ratio is a useful measure of insulin sensitivity in women with polycystic ovary syndrome. J. Clin. End. Metab. 1998; 83: 2694–2698.
32. National Cholesterol Education Program. Adult Treatment Panel III.
33. Tuomilehto J., Lindstrom J., Eriksson J.G. i wsp.: Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. NEJM 2001; 344: 1343–1350.
34. Eriksson K.F., Lindgard F.: Prevention of type 2 (non-insulin -dependent) diabetes mellitus by diet and physical exercise: the 6-year Malmo feasibility study. Diabetologia 1991; 34: 891–898.
35. Pan X.R., Li G.W., Hy Y.H.: Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance: the Da Qing IGT and Diabetes Study. Diabetes Care 1997; 20:537–544.
36. American Diabetes Association: Recommendations 2001. Diabetes Care 2001; supl. 1.
37. Bailey C.J., Path M.C.R., Turner R.C.: Metformin. NEJM 1996;334: 574.
38. Velazquez E.M., Mendoza S.G., Wang P., Glueck C.J.: Metformin therapy is associated with a decrease in plasma plasminogen activator inhibitor 1, lipoprotein (a) and immunoreactive insulin levels in patients with the polycystic ovary syndrome. Metabolism 1997; 46: 454–457.
39. Diamanti-Kanderakis E., Kouli C., Tsianateli T., Bergiele A.: Therapeutic effects of metformin on insulin resistance and hyperandrogenism in polycystic ovary syndrome. Eur. J. Endocr.
1998; 138: 269–274.
40. Stumvoll M., Nurjhan N., Perriello G., Dailey G., Gerich J.E.: Metabolic effects of metformin in non-insulin-dependent diabetes mellitus. NEJM 1995; 333: 550.
41. Sieradzki J.: Renesans metforminy. Przegl. Lek. 1999; 56: 331–334.
42. The Diabetes Prevention Program Research Group: The Diabetes Prevention Program. Design and methods for a clinical trial in the prevention of type 2 diabetes. Diabetes Care 1999; 22:623–634.
43. Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. NEJM 2002; 346: 393–403.
44. Chiasson J.L., Josse R.G., Gomis R., Hanefeld M., Karasik A., Laakso M. for the STOP NIDDM Trial: Research Group: Acarbose can prevent the progression of compaired glucose tolerance to type 2 diabetes mellitus: results of a randomized clinical trial. The STOP NIDDM Trial. Lancet 2002; 359: 2072–2077.
45. Sjostrom L., Torgerson J.S., Hauptman J., Boldrin M. Xendos (Xenical in the prevention of diabetes in obese subjects):a landmark study. 9 th Int. Congr. Obesity, Sao Paulo 2002.
46. American Diabetes Association and NIDDKD: The prevention or delay of type 2 diabetes. Diabetes Care 2002; 25: 742–749.
47. The prevention or delay of type 2 diabetes. Pract. Diabetes 2002; 20: 109–116.
48. Buchanan T.A., Xiang A.H., Peters R.K. i wsp.: Prevention oftype 2 diabetes: the role of pancreatic B-cell rest (w druku).
artykuł zamieszczono za zgodą wydawcy Via Medica
Prof.zw.dr hab.med. Jacek Sieradzki Uniwersytet Jagieloński Collegium Medicum
ISSN 1732-0224
OTYŁOŚĆ – JAKO STAN ZAGROŻENIA ŻYCIA
Definicja otyłości
- Złożona, wieloczynnikowa, przewlekła choroba spowodowana stylem życia promującym dodatni bilans energetyczny, manifestująca się u ludzi z genetyczną predyspozycja do otyłości
- BMI > 30 kg/m2
Wzrost częstości otyłości w wybranych krajach na świecie
Baker R. et all: Obes Rev 2010, 11: 835
Rozpowszechnienie (%) nadwagi i otyłości
w podgrupach wiekowych w Polsce w 2002 r.
Przyczyny: Geny i czynniki środowiskowe
w etiologii otyłości
W miarę starzenia się coraz większy wpływ ma środowisko
Kontrola sytości i głodu – zamknięta pętla
System kontroli masy ciała
Pętla zwrotna (feedback system) – MÓZG a SYSTEM OBWODOWY
Czynniki wpływające na łaknienie i sytość
- Składniki pokarmowe:
- Białko – najsilniejszy wpływ na sytość
- Węglowodany – sytość
- Produkty wysokotłuszczowe – stymulują łaknienie
- Czynniki psychiczne/mózgowe:
- ulubione danie
- pora dnia
- nastrój (nuda, złość, depresja), stres
Przyczyny otyłości – komponenty wydatku energetycznego ustroju
Stopnie zaawansowania otyłości (WHO)
- normowaga 19-24,9 kg/m2
- nadwaga 25-29,9km/m2
- otyłość małego stopnia 30-34,9 kg/m2
- otyłość dużego stopnia 35-39,9 kg/m2
- otyłość olbrzymia >40kg/m2
Ocena stopnia otyłości
- BMI – można wyliczyć za pomocą:
- wzoru masa ciała / wzrost(2) * [kg/m2]
- normogramu
- tabeli
Rozkład tkanki tłuszczowej typu „jabłko” i „gruszka”
Metody ilościowej i jakościowej oceny tkanki
Prawidłowa ilość tkanki tłuszczowej
- 21 – 35% dla kobiet
- 8 – 24% dla mężczyzn
Przyczyny rozwoju powikłań otyłości – własności sekrecyjne tkanki tłuszczowej
Zespół zaburzeń metabolicznych w otyłości
- Insulinooporność
- nietolerancja glukozy CUKRZYCA
- hiperinsulinemia
- Zaburzenia lipidowe
- aktywacja adrenergiczna
- aktywacja układu RAA
- nadciśnienie (zmiany strukturalne w nerkach) NADCIŚNIENIE TĘTNICZE, CHOROBA NIEDOKRWIENNA SERCA
- skłonność prozakrzepowa
- hiperleptynemia
Choroby współtowarzyszące otyłości
Częstość chorób towarzyszących otyłości
Cukrzyca typu 2 57%
Nadciśnienie tętnicze 17%
Choroba niedokrwienna serca 17%
Choroby pęcherzyka żółciowego 30%
Osteoarthritis 14%
Rak piersi 11%
Rak macicy 11%
Rak odbytnicy 11%
Obniżenie jakości życia z powodu otyłości
- niska samoocena
- okresy występowania depresji
- izolacja społeczna
- kłopoty z zatrudnieniem
- „wczesna” renta (zmniejszenie dochodów)
- brak akceptacji własnego wyglądu
Dr n. med. Katarzyna Cyganek
Klinika Chorób Metabolicznych
Szpital Uniwersytecki w Krakowie
kierownik: Prof. dr. hab. med. Maciej Małecki
Genetyka na widelcu
Personalizacja zaleceń żywieniowych stanowi nową koncepcję podejścia do dietetyki. Trenerzy personalni i dietetycy projektują indywidualne jadłospisy w oparciu o wiek, wagę, wzrost oraz poziom aktywności fizycznej swoich podopiecznych. Czy można jeszcze bardziej dopasować dietę do konkretnej osoby? Okazuje się, że można. Taką możliwość daje nowatorska koncepcja badań nutrigentycznych GENOdiagDIETA oferowanych przez ogólnopolską sieć laboratoriów medycznych DIAGNOSTYKA.
Czym są badania nutrigenetyczne?
Nutrigenetyka jest stosunkowo młodą gałęzią badań, poszukującą związków pomiędzy nutri-czyli żywieniem, a genetyką- czyli analizą genów. Badania nutrigenetyczne GENOdiagDIETA prezentują nowoczesne oblicze dietetyki, ponieważ ich metodyka polega na analizie DNA, czyli kodu genetycznego. Kod genetyczny stanowi swego rodzaju „paszport”, w którym zapisane są nasze indywidualne dane takie jak kolor oczu i włosów, jak również predyspozycje do otyłości czy aktywność różnych enzymów. Budowa każdej komórki ciała, funkcjonowanie każdego procesu w organizmie zaprogramowane jest w DNA. Zatem wykonując analizę wybranych genów związanych z metabolizmem, jesteśmy w stanie z dużym prawdopodobieństwem przewidzieć, jak zareaguje nasz organizm na różne składniki diety.
Dla kogo są badania nutrigenetyczne i po co je robić?
Panele badań nutrigenetycznych GENOdiagDIETA może wykonać każdy, kto chce odżywiać się świadomie. Nie ma dla nich ograniczeń wiekowych, a wykonane u dzieci pozwolą odpowiedzialnie wykształcić ich nawyki żywieniowe. Często zadajemy sobie pytania typu: „Dlaczego kolejna dieta nie działa i nie chudnę?”, „Dlaczego mam wysoki cholesterol, chociaż nie mam nadwagi?”, „Czy modna obecnie dieta bezglutenowa jest dla mnie? Czy nie zaszkodzę sobie bardziej niż pomogę?”, „Czy palenie szkodzi każdemu tak samo?” Okazuje się, że odpowiedzi na te i podobne pytania można poszukać w genach.
GENOdiagDIETA – geny metabolizmu i otyłości
Wyniki pierwszego panelu badań GENOdiagDIETA – geny metabolizmu i otyłości wskażą z jednej strony na predyspozycje do genetycznie uwarunkowanej otyłości, z drugiej pozwolą w oparciu o poznane warianty genetyczne w tym obszarze metabolizmu, ustalić odpowiednie proporcje makroskładników, czyli cukrów i tłuszczów w diecie. Taka analiza oceni także predyspozycje do zaburzeń lipidowych, u podstaw których leżą choroby cywilizacyjne, takie jak miażdżyca czy choroba niedokrwienna serca, a także ryzyko rozwoju cukrzycy typu 2-go, jeśli wykryjemy predyspozycje do insulinooporności.
GENOdiagDIETA – geny nietolerancji pokarmowych
Popularne ostatnio stosowanie diet eliminacyjnych, takich jak np. dieta bezglutenowa czy bezlaktozowa jest modne, ale czy w każdym wypadku uzasadnione? Jeśli coś eliminujemy powinniśmy wiedzieć czym należy pewna grupę produktów zastąpić, żeby nie pozbawić się ważnych mikroelementów. Analizując geny związane z szeroko pojętą wrażliwością pokarmową w panelu badań GENOdiagDIETA – geny nietolerancji pokarmowych można określić predyspozycje genetyczne do rozwoju celiakii (poważnej choroby związanej z brakiem tolerancji na gluten), a także dowiedzieć się, czy takie składniki diety jak kofeina, laktoza, sól kuchenna lub alkohol nie są dla organizmu za dużym obciążeniem, mogącym rodzić poważne konsekwencje. Znając swój genotyp w tym obszarze można modyfikować dietę zgodnie z możliwościami organizmu, świadomie wykluczając grupy pokarmów lub zastępując je innymi.
GENOdiagDIETA – geny metabolizmu witamin i antyoksydantów
Także genetycy poszukują „Eliksiru młodości” angażując się w badania nad genami związanymi z procesami starzenia się organizmu, oraz tymi, które się mu przeciwstawiają. Na wolne rodniki, jednego z głównych sprawców starzenia się i rozwoju chorób narażeni są wszyscy, ponieważ są one integralną częścią naszego życia. Jednak wydajność mechanizmów obronnych organizmu jest u każdego inna i również jest zapisana w DNA. Zanieczyszczone środowisko, chemizacja przemysłu spożywczego, promieniowanie UV, dym papierosowy czy alkohol, w przypadku niedostatecznej obrony naszego organizmu mogą prowadzić do tzw. stresu oksydacyjnego, czyli sytuacji, kiedy ilość wolnych rodników przewyższa możliwości antyoksydacyjne (tj. naturalne mechanizmy obronne organizmu). Te naturalne mechanizmy obrony – tarcza ochronna przed wolnymi rodnikami, stanowią z jednej strony wewnętrzne układy enzymatyczne, z drugiej witaminy i minerały dostarczane wraz z pożywieniem. Warto więc poznać warianty genetyczne odpowiedzialne za „zmiatanie wolnych rodników” i zapotrzebowanie na mikroelementy, aby dowiedzieć czy i w jakim stopniu należy w tym zakresie wspomagać organizm odpowiednią dietą lub ewentualną suplementacją. Trzeci panel badań GENOdiagDIETA – geny metabolizmu witamin i antyoksydantów daje taką możliwość.
Wyniki badań nutrigenetycznych dają narzędzie do personalizacji zaleceń dietetycznych w oparciu o indywidualny kod genetyczny. Pozwalają na świadome zaplanowanie sposobu odżywiania, zgodne z rytmem i potrzebami własnego organizmu. Stawiając na profilaktykę pomagają jak najdalej odsunąć w czasie, a wręcz skutecznie zapobiec rozwojowi chorób, zwłaszcza chorób cywilizacyjnych, których ryzyko społecznego wystąpienia jest coraz większe. Świadomość wynikająca z badań predyspozycji genetycznych daje bowiem silny bodziec do zamiany stylu i sposobu życia, tak aby jak najdłużej cieszyć się zdrowiem ciała i komfortem ducha.
Anna Piotrowska-Mietelska
Ogólnopolska Sieć Laboratoriów Medycznych DIAGNOSTYKA
GENOdiagDIETA
Twój własny przepis na dietę
Nieoficjalny światowy rekord zawartości alkoholu we krwi wynosi 14,8 promila i należy do Polaka. To nie przypadek, że ten niechlubny wynik osiągnął akurat nasz rodak – pomogły mu w tym geny. Polacy, podobnie jak większość ludzi rasy kaukaskiej mają „korzystne” warianty genów kodujących enzymy zaangażowane w metabolizm alkoholu. Geny warunkują bowiem nie tylko cechy widoczne na pierwszy rzut oka, takie jak kolor skóry, oczu czy wzrost, ale wpływają też na to, jak organizm funkcjonuje ”od środka” – jak wydajnie radzi sobie z przyswajaniem i metabolizowaniem składników odżywczych, czy sprawnie neutralizuje toksyny, a w końcu – czy jest podatny na starzenie. W genach może też być zapisane zwiększone prawdopodobieństwo zapadnięcia na określone choroby, takie jak celiakia czy niektóre typy nowotworów.
GEN, POLIMORFIZM, MUTACJA – O CO TU CHODZI?
Każdy z nas posiada swój unikalny kod genetyczny. Choć brzmi to dość tajemniczo, w rzeczywistości to czysta biochemia! Kod genetyczny można porównać do przepisu na to, jak ma być zbudowane i jak ma funkcjonować nasze ciało. Przepis ten zapisany jest językiem biochemii – sekwencją tzw. deoksynukleotydów, znanych jako DNA. DNA jest nośnikiem informacji o wszystkich białkach organizmu. Informacja ta przepisywana jest na RNA, który jest „kopią roboczą DNA” – bezpośrednią matrycą, na bazie której powstają białka. Białka z kolei budują nasze ciało (jak np. kolagen), spełniają jego podstawowe funkcje życiowe (jak przenosząca do tkanek tlen hemoglobina), wpływają na jego odporność (immunoglobuliny, cytokiny). Co więcej, jako hormony białkowe i enzymy białka niejako dyrygują pracą całego organizmu, warunkując kierunek i intensywność przemian metabolicznych.
Kiedy w 2003r. ogłoszono zsekwencjonowanie ludzkiego genomu, zachwytom nie było końca. Trzeba jednak przyznać, że oznaczało to, że poznano kolejność zasad w DNA – ale nadal przypominało to przepisanie na alfabet łaciński tekstu w jakimś nieznanym języku. Znamy tylko urywki tego języka – opisano ok. 20 tysięcy genów, a więc fragmentów DNA, których ekspresja powoduje (najczęściej) powstanie określonego białka. Jest to jednak tylko niewielka część genomu. Znaczenie pozostałej części pozostaje do wyjaśnienia, choć już teraz wiemy, że przepisywanie informacji z DNA może zakończyć się na etapie RNA. W takim wypadku RNA nie jest tylko pomocnikiem, lecz spełnia funkcje enzymów i regulatorów ekspresji genów (rybozymy, mikroRNA).
Sekwencjonowanie poszczególnych genów pozwoliło jednak na wykrycie drobnych różnic ich budowy (wariantów genów, polimorfizmów) pomiędzy ludźmi. Różnice te, jeśli występują w populacji często, nazywane są polimorfizmami określonego fragmentu genu i to właśnie one wpływają np. na kolor oczu. Jeśli są to zmiany rzadsze, to mówimy o mutacjach, które często mają wpływ na wystąpienie określonej jednostki chorobowej. To co mamy w genach, łącznie z polimorfizmami i mutacjami, to jednak tylko „lista składników” przepisu na naszą biologię. Tak jak przyprawy i sposób przygotowania decydują o finalnym smaku przygotowywanego dania, tak o naszym dobrym samopoczuciu i zdrowiu decydują tzw. czynniki środowiskowe. Znając predyspozycje genetyczne możemy świadomie kształtować nawyki żywieniowe, mocniej zmotywować się do unikania używek czy podjęcia aktywności fizycznej. Ten całokształt działań najlepiej rozpocząć od ukierunkowanej diagnostyki genetycznej. Zespół diagnostów – biologów molekularnych z laboratoriów sieci DIAGNOSTYKA przygotował trzy pakiety badań genetycznych, oceniających polimorfizmy genów wpływających na metabolizm węglowodanów i tłuszczów, odpowiadających za tolerancję takich składników żywieniowych jak laktoza, sól czy alkohol oraz genów związanych ze zwalczaniem przez organizm wolnych rodników i metabolizmem witamin.
Do kogo adresowane są badania genetyczne? Do wszystkich! Skorzystać z ich mogą zarówno osoby dbające o swoje zdrowie na co dzień, jak i te, którym do diet i ćwiczeń „nie po drodze”. Ustalenie profilu genetycznego dla tych pierwszych będzie stanowić drogowskaz, który pokaże, jaki kierunek obrać, by wysiłki szły w dobrym kierunku, dla tych drugich okazać się może motywacją do zadbania o ciało – bo od jego dobrej kondycji zależy też stan ducha! Nasze badania mogą też być pomocne tym, którzy pomimo starań nie mogą zrzucić zbędnych kilogramów – okazać się może, że np. stosowana dieta Kwaśniewskiego wybitnie nie służy danej osobie, gdyż jej geny predysponują ją do nasilonego magazynowania tłuszczów. Co ważne, profil genetyczny towarzyszy nam od narodzin do śmierci, sensowne jest więc jego oznaczenie już u małego dziecka. Taki prezent pozwala kształtować właściwe, dostosowane do predyspozycji genetycznych nawyki żywieniowe już od najmłodszych lat – stanowić swego rodzaju polisę zdrowotną dziecka. Zauważmy też, że genetyczne uwarunkowania często ujawniają się dopiero z wiekiem lub w specyficznych stanach fizjologicznych, takich jak ciąża. Dlatego nawet osoby „od zawsze” szczupłe i nie mające problemów ze zdrowiem skorzystać mogą na poznaniu swojego profilu genetycznego – uniknąć pojawienia się „oponki” po trzydziestce czy nadmiernego przybierania na wadze w trakcie ciąży.
PAKIET I
Pakiet I obejmuje ocenę polimorfizmów genów wpływających na to, jak organizm metabolizuje węglowodany (potocznie mówiąc: cukry) i lipidy (tłuszcze). Do genów tych należą: FTO, FABP2, PPARγ, Apo E i ADB3. Co kryje się pod tymi symbolami?
Gen FTO – z ang. fat mass and obesity associated gene, w Polsce nazywany jest genem podatności na otyłość. Występowanie niekorzystnej formy tego genu wiązane jest z zaburzonym odczuwaniem głodu i sytości (przejadanie się, podjadanie między posiłkami), więc u nosicieli tego polimorfizmu obserwuje się zwiększone BMI (Body Mass Index) i obwód talii. Otyłość prowadzić też może do rozwoju cukrzycy 2 typu.
Gen FABP2 – z ang. fatty acid binding protein 2, czyli gen kodujący białka biorące udział we wchłanianiu, przetwarzaniu i transportowaniu kwasów tłuszczowych. Jego niekorzystny polimorfizm sprzyja występowaniu m.in. podwyższonego stężenia „złego” cholesterolu LDL we krwi i zwiększonemu magazynowaniu kwasów tłuszczowych w tkankach.
Gen PPARγ – z ang. peroxisome proliferator activated receptor gamma, kodujący białka receptorowe wpływające na metabolizm zarówno tłuszczów, jak i węglowodanów. W zależności od tego, nosicielami którego z jego polimorfizmów jesteśmy, mamy zwiększone predyspozycje do tycia na skutek nadmiernego spożycia węglowodanów lub tłuszczów.
Gen APOE – koduje apolipoproteinę E, biorącą udział w metabolizmie tłuszczów. Choć 60% populacji ma prawidłową formę tego genu – APOE3, to pozostałe jego warianty: APOE2 i APOE4 wskazują na ryzyko zaburzeń w poziomach lipidów we krwi.
Gen ADRB3 – z ang. adrenoreceptor beta 3, koduje białko receptorowe biorące udział w rozkładzie tłuszczów i odpowiadające za utrzymanie stałej temperatury ciała. Niektóre polimorfizmy tego genu wiązane są otyłością i mogą podnosić ryzyko wystąpienia cukrzycy typu 2.
Wyników oznaczenia profilu genetycznego w zakresie genów odpowiadających za metabolizm węglowodanów i tłuszczów nie należy traktować jako usprawiedliwienia dla nadwagi lub „wyroku” skazującego na gorsze zdrowie. Odpowiednia profilaktyka (przemyślana dieta i aktywny tryb życia) nawet u osób obciążonych niekorzystnymi polimorfizmami badanych genów może pomóc uniknąć otyłości i rozwoju chorób metabolicznych (miażdżyca i inne choroby sercowo-naczyniowe, cukrzyca). Pomocą w skutecznej profilaktyce może też być regularne (coroczne) wykonywanie podstawowych oznaczeń biochemicznych z krwi, takich jak lipidogram czy glukoza.
PAKIET II
Analizując dietę pod kątem białek, cukrów i tłuszczów rozważamy ich ilość i wzajemne proporcje. Są to przecież główne składniki żywieniowe, pełniące krytyczne dla naszego przeżycia funkcje, więc ich zupełna eliminacja nie wchodzi w rachubę. Musimy jeść cukry m.in. dlatego, że glukoza to jedyne źródło energii dla mózgu, białka pokarmowe dostarczają aminokwasów, których organizm nie jest w stanie sam wytworzyć, tłuszcze zaś potrzebne są np. do budowy błon komórkowych wszystkich komórek ciała. Zdarza się jednak, że jedno konkretne białko lub cukier powoduje w organizmie więcej szkody niż pożytku – koronnym przykładem może być odpowiednio gluten i laktoza.
Gluten to białko występujące w pszenicy, życie i jęczmieniu. Powodować on może całe spektrum schorzeń: od nadwrażliwości na gluten (z objawami gastrycznymi, ciągłym zmęczeniem), przez alergię na to białko (mogącą prowadzić nawet do wstrząsu anafilaktycznego i śmieci), po celiakię, która nieleczona skutkuje nieuchronnym wyniszczeniem organizmu na skutek upośledzonego wchłaniania pokarmów, jak również do zaburzeń neurologicznych i endokrynologicznych, chorób nerek, wątroby i płuc. Celiakia to choroba autoimmunologiczna (czyli taka, w której organizm atakuje własne tkanki) o uwarunkowaniu genetycznym. Chorzy na celiakię są nosicielami HLA-DQ2, HLA-DQ8 lub HLA-DRB4, stanowiących warianty genów kodujących białka głównego układu zgodności tkankowej, biorące udział w uruchamianiu reakcji immunologicznej organizmu. Obecność wymienionych polimorfizmów wskazuje na predyspozycje do rozwoju celiakii, a w przypadku podejrzenia tej choroby pomaga w jej diagnostyce różnicowej.
Nietolerancja laktozy, choć nie jest tak groźna jak celiakia, prowadzić może do dość nieprzyjemnych objawów gastrycznych. Po spożyciu mleka i niektórych jego przetworów pojawiać się mogą wzdęcia i bóle brzucha, gazy, biegunka. Najczęściej takie dolegliwości występują u dorosłych – matka natura z wiekiem „wyłącza” aktywność laktazy, enzymu, który dorosłym już nie jest niezbędny, gdyż ich dieta nie opiera się na mleku. Od strony genetycznej jest to związane z nosicielstwem określonych polimorfizmów genu kodującego laktazę.
Dania bezglutenowe i niezawierające laktozy goszczą już w menu wielu restauracji, dieta eliminująca te substancje jest w pewnym sensie modna. Przy braku przeciwwskazań zdrowotnych (określanych m.in. profilem genetycznym) lepiej jednak stosować dietę jak najbardziej zróżnicowaną.
Pakiet II obejmuje też ocenę polimorfizmów genów zaangażowanych w metabolizm substancji pokarmowych, które może nie są nam niezbędne, ale ich spożywanie po prostu sprawia przyjemność. Nadmierna konsumpcja takich substancji jak alkohol, kofeina i sól nieuchronnie prowadzi jednak do opłakanych skutków zdrowotnych.
Nosiciele określonych wariantów genów kodujących enzymy biorące udział w metabolizmie alkoholu, ALDH i ADH, lepiej tolerują tą używkę – objawy upojenia pojawiają się później, a „syndrom dnia następnego” ma łagodniejszy przebieg. W konsekwencji prowadzić to może do uzależnienia – z wszystkimi jego konsekwencjami.
Wielu z nas nie potrafi wyobrazić sobie dnia bez kilku „małych czarnych”. Filiżanka kawy dodaje energii, zwiększa koncentrację, dostarcza doznań smakowych. Osoby posiadające określone formy genu cytochromu CYP1A2 (białka uczestniczącego w metabolizmie kofeiny, ale także leków i trucizn) po wypiciu kawy mogą jednak odczuwać nadmierne pobudzenie, niepokój, występować u nich mogą zaburzenia snu.
Polimorfizmy genu enzymu konwertazy angiotensyny (ACE) pośrednio wpływają na to, jak organizm radzi sobie z nadmiarem soli. Sól – a dokładnie zawarty w niej sód – podnosi ciśnienie tętnicze krwi, co może prowadzić do chorób sercowo-naczyniowych. Ciśnienie tętnicze zwiększa się też wraz z aktywnością ACE, a ta jest różna w zależności od polimorfizmów kodującego ją genu.
Polimorfizmy genetyczne badane w pakiecie II pozwalają na wiarygodną ocenę tego, czy odczuwane przez nas dolegliwości są faktycznymi nietolerancjami pokarmowymi określonych składników żywieniowych. Oparta o wskazania medyczne dieta eliminacyjna i znajomość własnych ograniczeń w zakresie metabolizmu używek przynoszą poprawę jakości życia.
PAKIET III
W pakiecie III skupiliśmy się na ocenie wariantów genetycznych wpływających na zdolność organizmu do usuwania wolnych rodników i wykorzystywania dobroczynnego działania witamin.
Wolne rodniki to taka łobuzeria naszego ciała – związki chemiczne zawierające niesparowany elektron, „zaczepiające” stateczne struktury organizmu. Mogą uszkadzać błony komórkowe i DNA, prowadzić do rozwoju miażdżycy, nowotworów i przyspieszać starzenie się. Skąd się biorą? Ich powstawanie podczas fizjologicznych procesów metabolicznych jest nieuniknione, ale „ponadprogramowe” ilości wolnych rodników dostarczamy sobie sami paląc papierosy, nadmiernie się stresując i przepracowując oraz żyjąc w zanieczyszczonym środowisku. Na szczęście organizm dysponuje mechanizmami usuwającymi wolne rodniki. Należą do nich m.in. enzymy GST i SOD. Polimorfizmy SOD wiązane są z przedwczesnym starzeniem i zwiększoną zapadalnością na nowotwory, warianty GST warunkują zmienną podatność na karcynogeny i toksyny. Osoby obarczone niekorzystnymi wariantami genów enzymów SOD i GST mogą sobie pomóc zwracając uwagę na dostarczanie z dietą przeciwutleniaczy, zawartych m.in. w cytrusach, zielonej herbacie czy czerwonym winie. Dużą wagę osoby te powinny też przykładać do profilaktyki nowotworów – w tym regularnych badań, mogących wykryć chorobę już na jej wczesnym stadium Wymienić tu można np. morfologię z rozmazem (diagnostyka białaczek), cytologię ginekologiczną (rak szyjki macicy), czy w końcu oznaczanie poziomu markerów nowotworowych we krwi (np. PSA w kierunku raka prostaty). Wyniki tych badań należy zawsze konsultować z lekarzem!
Do wspomnianych powyżej przeciwutleniaczy należą też witaminy A, C oraz E. Pakiet III zawiera ocenę polimorfizmów genetycznych wpływających na efekty działania witaminy E w organizmie.
Inną witaminą, której niedobory lub nieprawidłowy metabolizm w organizmie wiązane są z nowotworami (a także chorobami autoimmunologicznymi) jest witamina D. Do koronnych jej funkcji należy regulacja gospodarki mineralnej, wpływa też na odporność. Witamina ta spełnia swe role za pośrednictwem receptora VDR. Receptor ten jest białkiem, którego gen – a jakże – ma różne warianty. Poszczególne polimorfizmy VDR mają wpływ na efekty działania witaminy D w organizmie.
Pakiet III zamyka oznaczanie polimorfizmów genu MTHFR, kodującego enzym biorący udział w przemianach aminokwasów i metabolizmie takich witamin jak kwas foliowy czy ryboflawina. Określone mutacje w tym genie mogą skutkować obniżeniem aktywności enzymu MTHFR, co prowadzi do wzrostu stężenia aminokwasu homocysteiny we krwi. Podwyższony poziom homocysteiny wiązany jest ze zwiększonym ryzykiem chorób zakrzepowych, może prowadzić do nawracających poronień.
Decydując się na oznaczenie polimorfizmów genetycznych w pakietach przygotowanych przez nasze laboratorium otrzymujecie Państwo coś więcej niż wynik. W raporcie z badania, oprócz informacji o stwierdzonych mutacjach genów, znajduje się kliniczna interpretacja wyniku, wyjaśniająca, jakie znaczenie dla zdrowia ma dany polimorfizm. Otrzymują Państwo również konkretne wskazówki, dotyczące diety, stylu życia i profilaktyki zdrowotnej, mające szczególne znaczenie dla nosicieli określonych polimorfizmów. Wszelkie informacje zawarte w raporcie z badania oparte są na wiarygodnych doniesieniach naukowych.
dr Emilia Martin
Sieć laboratoriów DIAGNOSTYKA